Verbesserungen in der Entwicklung von Biopharmazeutika
Hochwertige metallfreie LC-MS-Analyse von therapeutischen Oligonukleotiden
Dr. Gesa Schad, Dr. Björn T. Erxleben, Shimadzu Europa GmbH
In den vergangenen Jahren wurde das Potenzial von therapeutischen Oligonukleotiden zur Behandlung seltener und chronischer Erkrankungen erkannt und bereits mehrere solcher Arzneimittel wurden zugelassen. Die Analyse dieser Nukleinsäuren zur Bestätigung der Identität und Reinheit mittels LC-MS stellt eine Herausforderung dar, da Oligonukleotide mehrere reaktive Gruppen besitzen, was bei einem edelstahlbasierten UHPLC-System zur Adsorption an metallischen Oberflächen führen kann. Der vorliegende Artikel befasst sich mit der Verbesserung der Quantifizierungsleistung in der LC-MS-Analyse von Oligonukleotiden mit dem Nexera XS inert, einem bioinerten UHPLC-System.
Therapeutische Oligonukleotide sind Nukleinsäuren, die generell aus einigen wenigen bis zu mehreren Dutzend miteinander verbundenen Basen aufgebaut sind. Sie werden durch chemische Synthese hergestellt und wirken unmittelbar auf Organismen, indem sie die Translation bestimmter Proteine hemmen. Therapeutische Oligonukleotide zeichnen sich durch die zielgerichtete Behandlung spezifischer Erkrankungen aus und sind Teil einer neuen Welle von Biopharmazeutika, zu denen auch die mRNA-Impfstoffe gegen COVID-19 gehören. Wie in Abbildung 1 dargestellt, binden die DNA-Oligomere an ein Targetprotein oder eine RNA und werden erfolgreich zur Hemmung der Transkription und Genexpression eingesetzt. Auch bei der Aktivierung der angeborenen Immunantwort haben sie sich als wirksam erwiesen. Ein weiterer entscheidender Vorteil ist, dass die Suche nach neuen Wirkstoffkandidaten im Vergleich zu herkömmlichen Methoden weniger Zeit in Anspruch nimmt, da Oligonukleotide einfach zu entwerfen und zu synthetisieren sind.
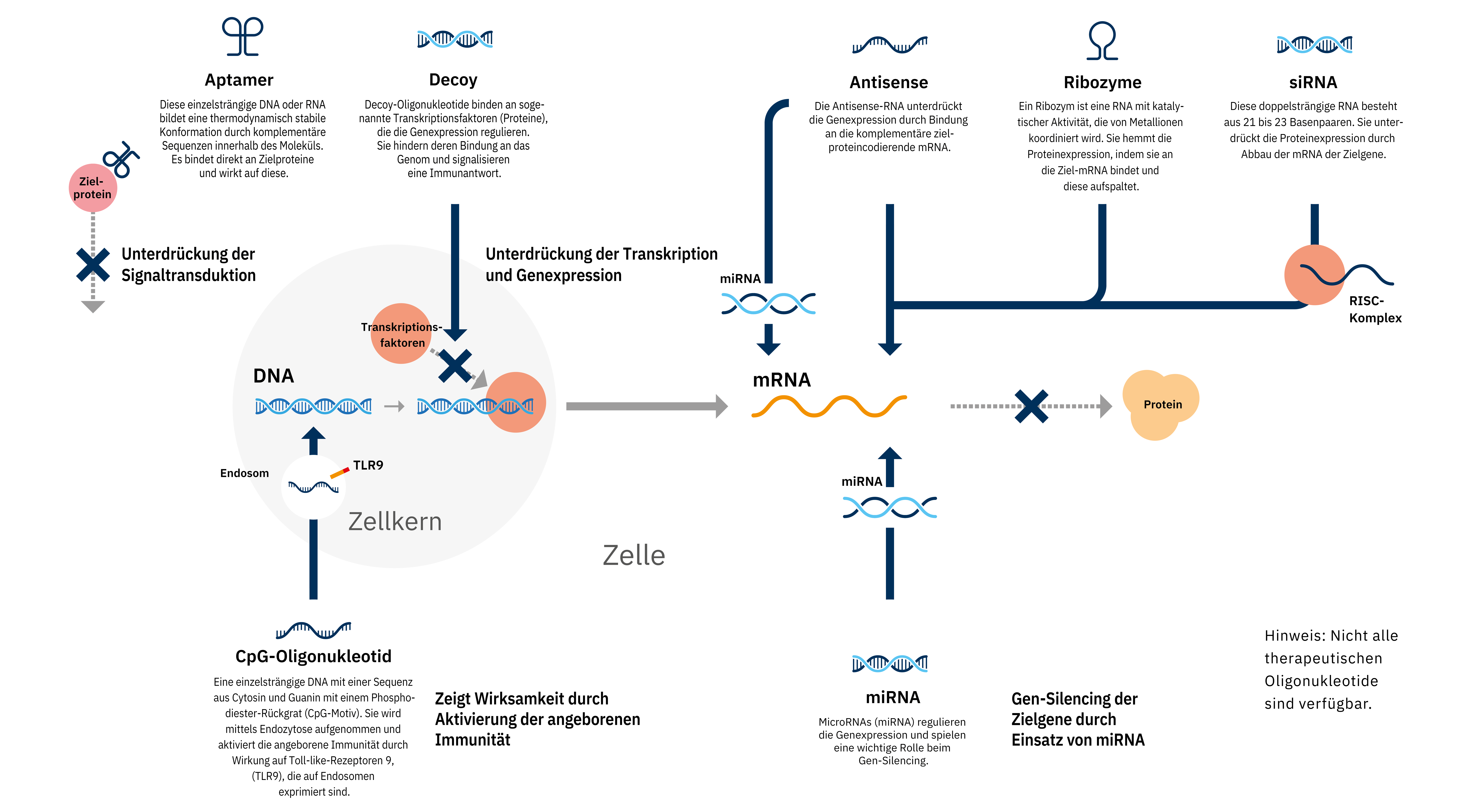
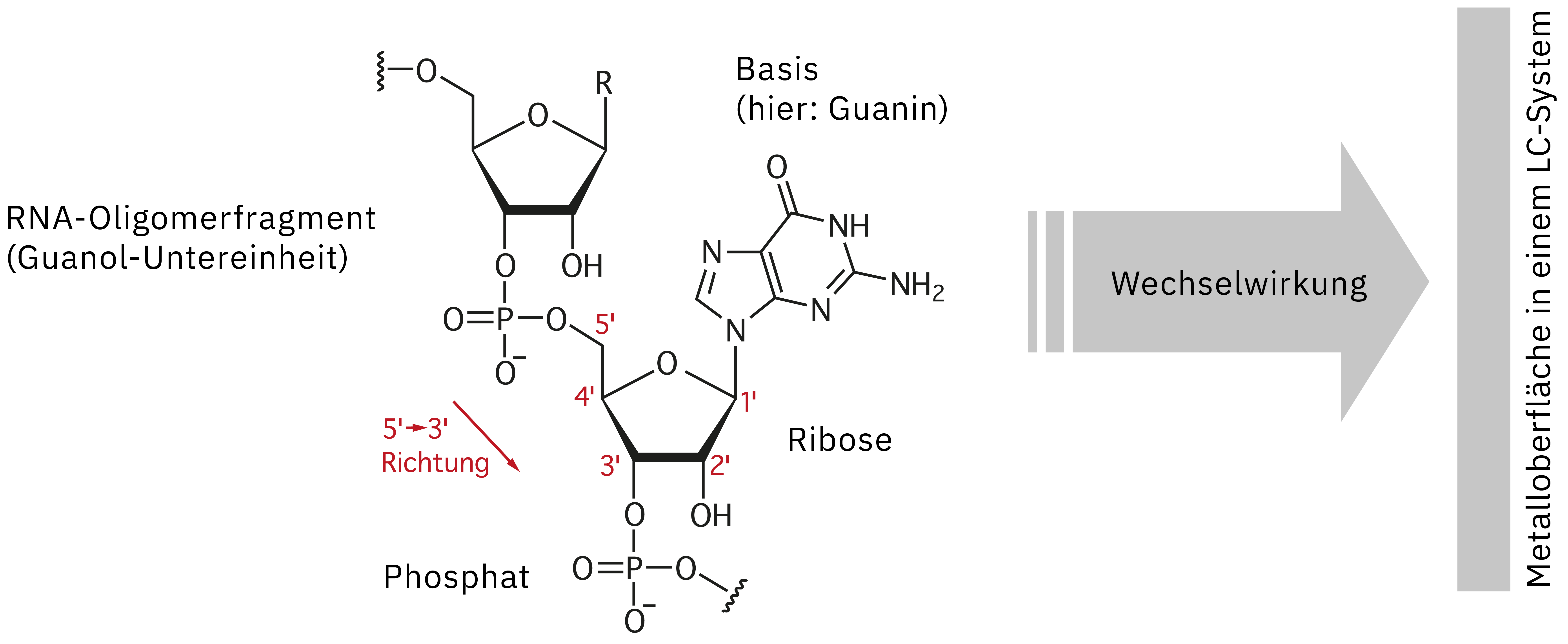
Ein praktisches Problem besteht jedoch darin, dass therapeutische Oligonukleotide nach der Verabreichung schnell von Exo- und Endonukleasen abgebaut werden, die in großer Anzahl im Blut und in den Zellen vorkommen. Diesem Problem begegnet man mit der Einführung modifizierter Oligonukleotide zur Verbesserung der chemischen Stabilität in vivo sowie mit der Entwicklung von Drug-Delivery-Systemen (DDS) zur zielgerichteten Behandlung von Läsionen. Der Forschungs- und Entwicklungsprozess bei therapeutischen Oligonukleotiden umfasst die Auswahl des Targets, die Oligomersynthese, die Reinigung, Charakterisierung und Qualitätskontrolle [1]. Eine gründliche Charakterisierung und Qualitätskontrolle durch Bestätigung der Molekülmasse, Konzentration und Sequenz der Oligonukleotide sind wichtig, um die Sicherheit und Wirksamkeit eines Arzneimittels zu gewährleisten, da die Erkennung von Target-Molekülen dadurch beeinflusst wird.
Um die Identität von synthetisch hergestellten Arzneimitteln wie therapeutischen Oligonukleotiden zu bestätigen und diese auf ungewollte Unreinheiten zu untersuchen, hat sich das Verfahren der LC-MS-Analyse bewährt. Die Analyse dieser Nukleinsäuren ist jedoch mit einigen wesentlichen Herausforderungen verbunden, da sie mehrere reaktive Gruppen besitzen, die zu einer Adsorption an Metalloberflächen eines edelstahlbasierten UHPLC-Instruments führen können (Abb. 2). Diese Wechselwirkung führt zu mangelhaften Peak-Formen, einer verringerten Empfindlichkeit und mangelnder Reproduzierbarkeit. Die wiederholte Injektion einer hoch konzentrierten Probe ist eine Möglichkeit, um ein System vor der eigentlichen Datenerfassung zu passivieren und so die Adsorptionsstellen auf der Metalloberfläche zu „sättigen“ und den Probeverlust zu verringern. Bei diesem Ansatz wird jedoch nicht nur Zeit und wertvolles Probenmaterial verschwendet – auch die Erfassung verlässlicher Daten kann aufgrund des laufend veränderten Zustands der Passivierung während der Analyse deutlich erschwert werden. Alternativ könnten Chelatbildner verwendet werden, um die Adsorption zu unterdrücken. Dies kommt bei der LC-MS-Analyse jedoch nicht infrage, da die Ionenquelle kontaminiert werden und die Empfindlichkeit nachlassen könnte. Der vorliegende Artikel beschreibt die Verbesserung der Quantifizierungsleistung bei der LC-MS-Analyse von Oligonukleotiden mit dem Nexera XS inert, einem bioinerten UHPLC-System.
Die für die Analyse verwendete Probe war ein Oligonukleotid mit der Sequenz 5’-dG-dC*-dC*-dT-dC*-dA-dG-dT-dC*-dT-dG-dC*-dT-dT-dC*-dG-dC*-dC*-3’, wobei (*) für eine 5-C- oder 5-U-Methylierung und (d) für 2’-Desoxynukleosid steht. Die Molekülmasse betrug 6.431,72.
Um den Effekt eines bioinerten Systems mit metallfreier Flusslinie zu bewerten, wurde die Analyse sowohl mit einem edelstahl(SUS-)basierten UHPLC-System (Nexera XR) mit SUS-Trennsäule als auch mit dem bioinerten Nexera XS inert mit metallfreier Säule durchgeführt. Die analytischen Bedingungen sind in Tabelle 1 ausführlich dargestellt. Als Ionenpaarreagenzien wurden HFIP (1,1,1,3,3,3-Hexafluoro-2-propanol) und DIPEA (N,N-Diisopropylethylamin) verwendet, wie es bei der Reversed-Phase-Analyse von Oligonukleotiden üblich ist.
|
HPLC-Bedingungen (Nexera XR, Nexera XS inert) |
|
|
Säule: |
Shim-pack Scepter C18-120 (100 x 2,1 mm, 3 µm) Shim-pack Scepter C18-120 (100 x 2,1 mm, 3 µm), metallfrei |
|
Mobile Phase A: |
50 mmol/l HFIP + 10 mmol/l DIPEA in Wasser |
|
Mobile Phase B: |
Acetonitril |
|
Volumenstrom: |
0,3 ml/min |
|
Gradient: |
5 %B (0—1 min), 5-30 % B (1—6 min), 95 %B (6,1—7 min), 5 %B (7,1—12 min) |
|
MS-Bedingungen (LCMS-8060) |
|
|
Ionisierung: |
ESI (negativer Modus) |
|
Sondenspannung: |
-4 kV |
|
Modus: |
MRM (m/z 803,5 > 95,0) |
|
CID-Gas: |
330 kPa |
|
Vernebelungsgasstrom: |
3,0 l/min |
|
Trocknungsgasstrom: |
8,0 l/min |
|
Heizgasstrom: |
12.0 l/min |
|
DL-Temperatur: |
300 °C |
|
Heizblocktemperatur: |
450 °C |
|
Interface-Temperatur: |
250 °C |
Ergebnisse und Diskussion
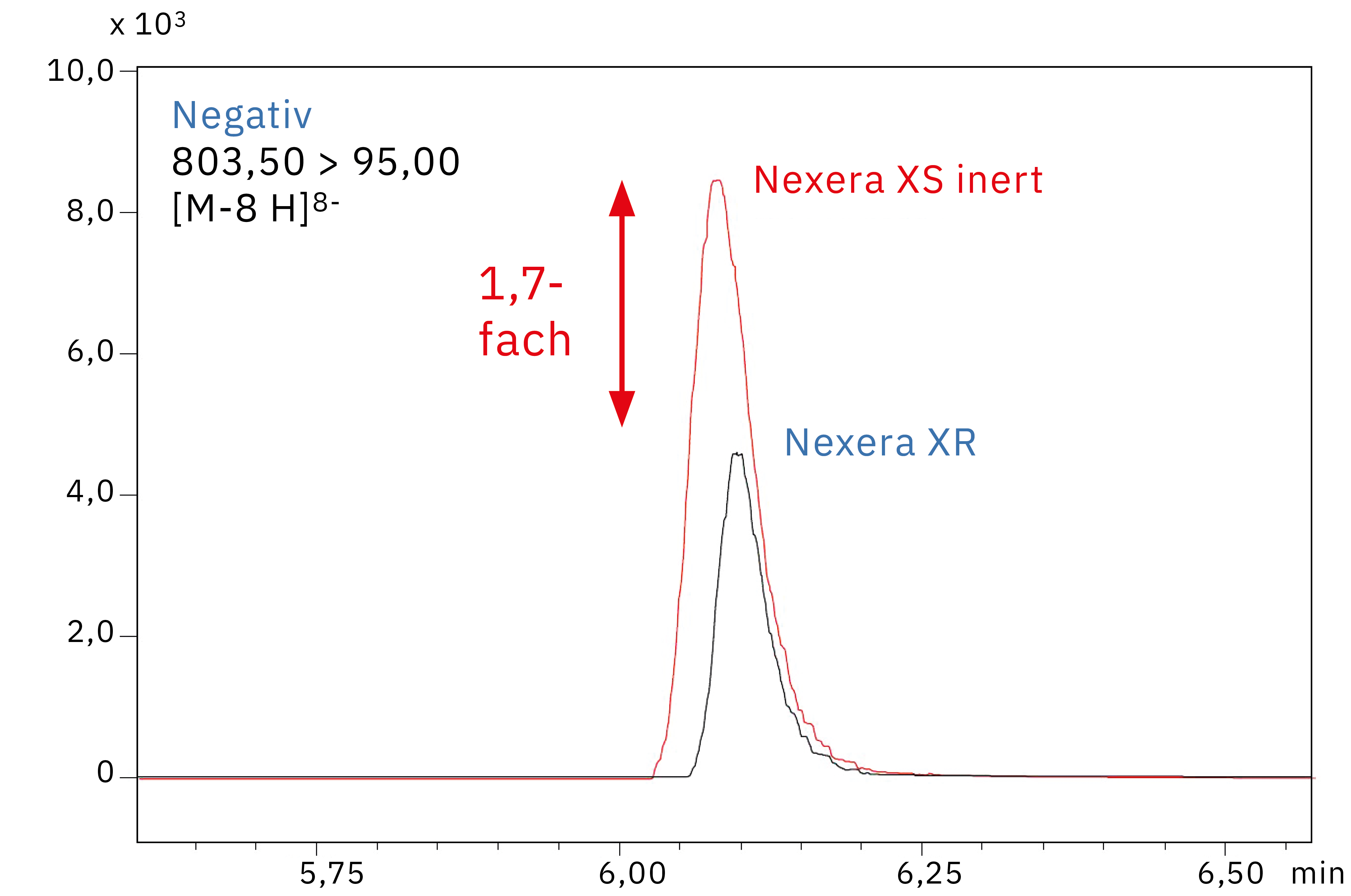
Abbildung 3 zeigt Chromatogramme aus der Analyse einer 10 ng/ml Oligonukleotid-Standardlösung mit einem herkömmlichen Nexera XR UHPLC-System mit SUS-Säule und dem neuen Shimadzu Nexera XS inert mit metallfreier Säule. Die Ergebnisse zeigen, dass die Empfindlichkeit etwa um das 1,7-Fache zunimmt, wenn Metall aus der Flusslinie entfernt wird.
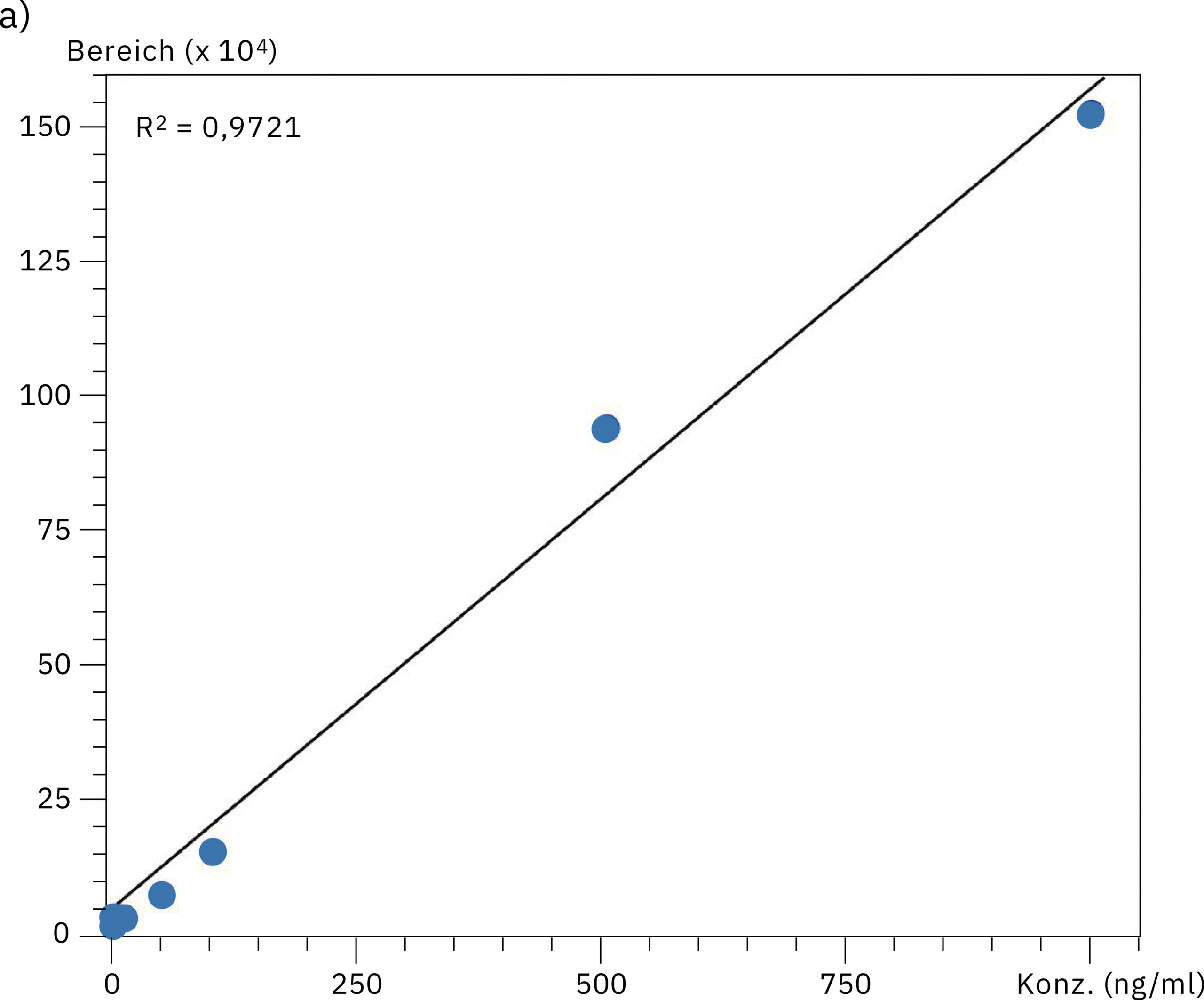
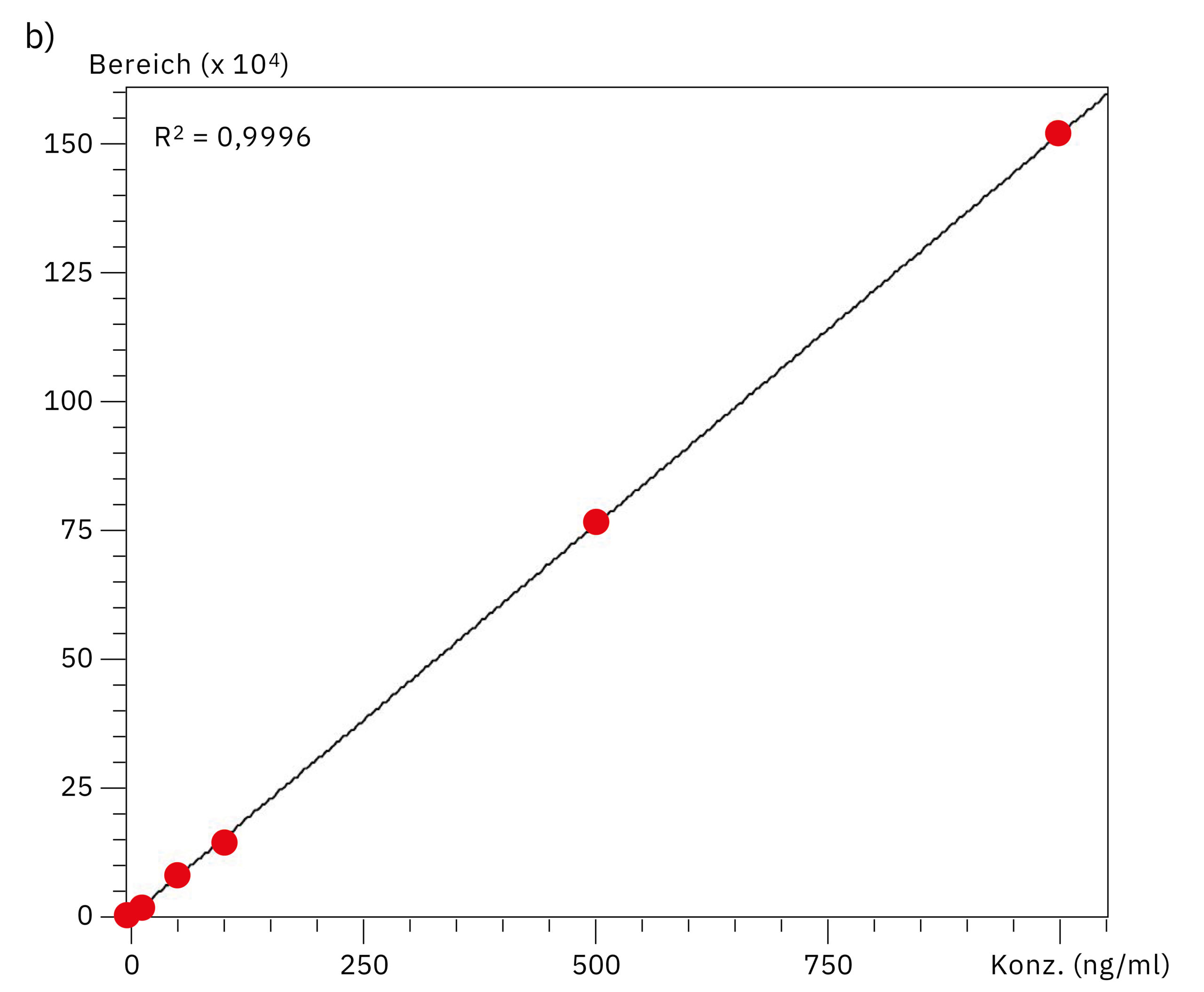
Zum Vergleich der Leistung beider Systeme bei der quantitativen Analyse von Oligonukleotiden wurden Kalibrierungskurven im Bereich von 0,5–1.000 ng/ml erstellt. Das Diagramm, das sich aus den Daten des SUS-basierten Nexera XR Systems ergibt, zeigt einen niedrigeren Wert für die lineare Regression (R2=0,9721) gegenüber der ausgezeichneten Linearität des bioinerten Systems (R2=0,9996), was den Effekt der Metalladsorption auf die Genauigkeit der Quantifizierung bei der hochempfindlichen LC-MS-Analyse von Oligonukleotiden hervorhebt. Die Daten zur Linearität und Genauigkeit an den einzelnen Kalibrierungspunkten sind in Tabelle 2 und Abbildung 4 dargestellt. Diese Werte zeugen davon, dass sich die Zuverlässigkeit durch Verwendung des Nexera XS inert mit metallfreier Trennsäule insbesondere bei Proben mit sehr geringer Konzentration verbessern lässt.
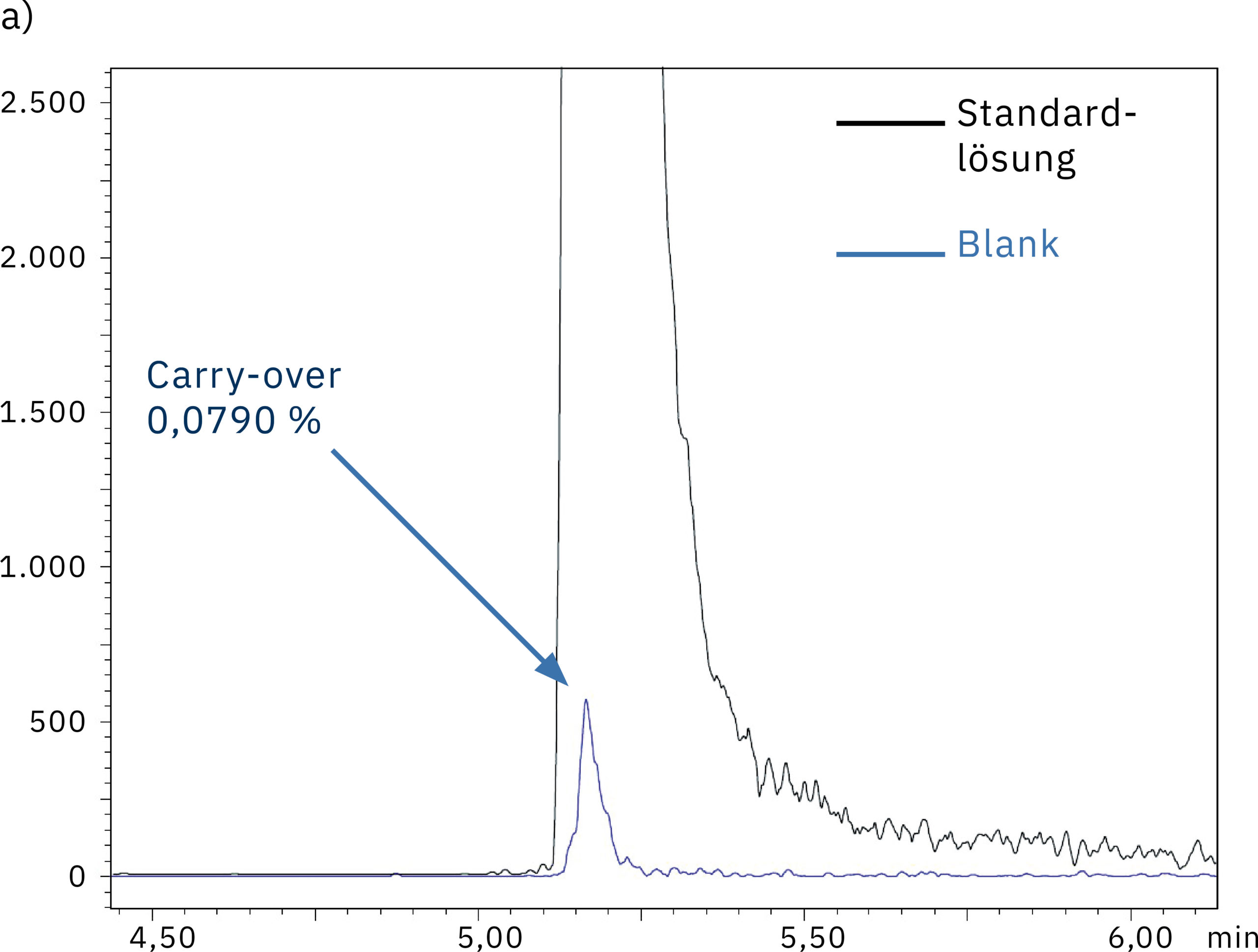
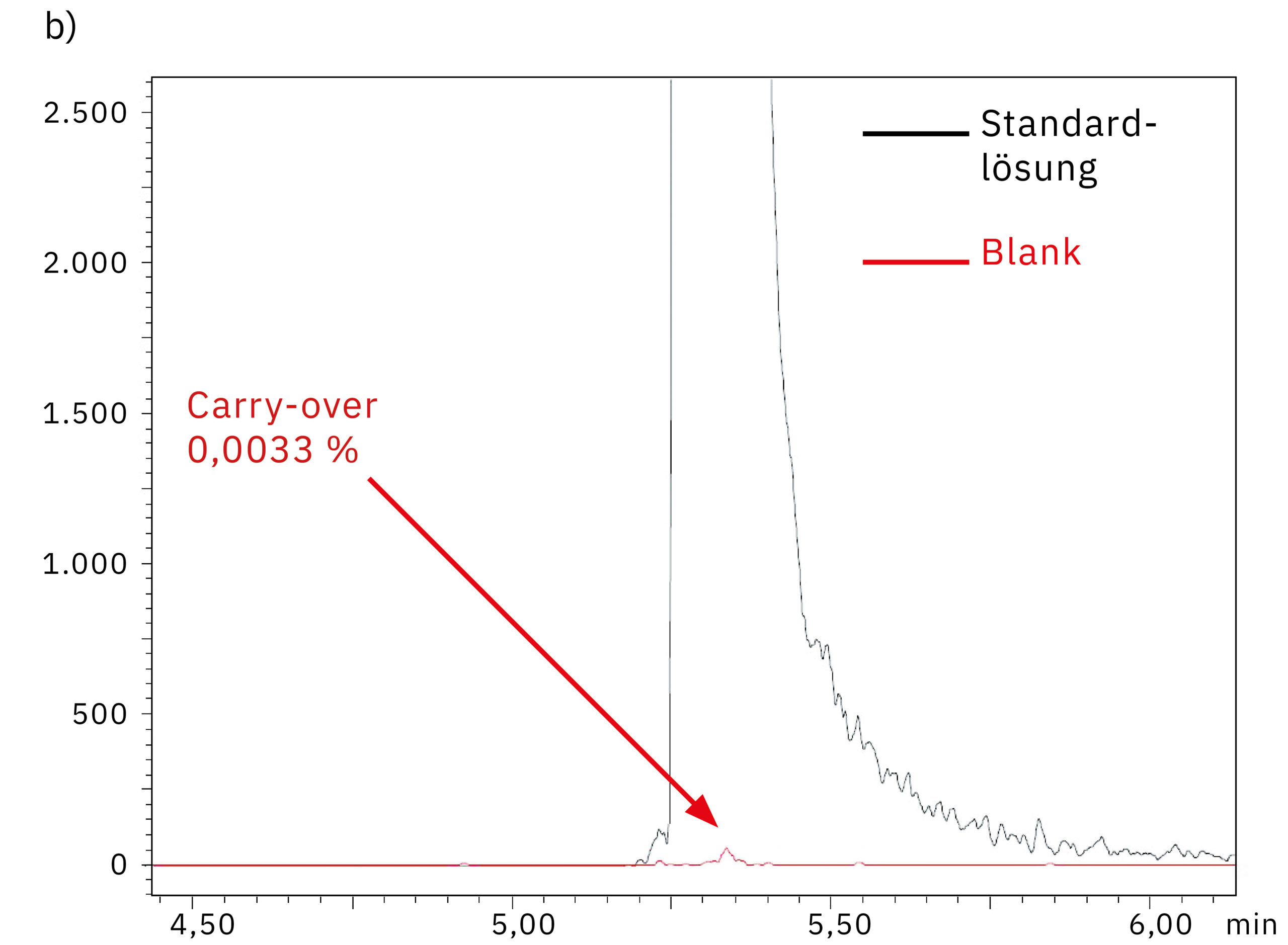
Um die Systemleistung in Bezug auf den Carry-over-Effekt zu messen, wurde unmittelbar nach einer Messung von 1.000 ng/ml Oligonukleotidlösung reines Wasser injiziert. Abbildung 5 zeigt den Vergleich der Chromatogramme, die durch Injektion dieser Blindprobe in das SUS-basierte Nexera XR System (a) und das bioinerte Nexera XS inert System (b) erzielt wurden. Die Ergebnisse und die Carry-over-Werte von 0,079 % bzw. 0,003 % zeugen davon, dass die Metalladsorption beim Nexera XS inert ausbleibt, wodurch auch der Carry-over beim nächsten Probenlauf minimiert wird.
|
Konzentration (ng/ml) |
Nexera XR |
Nexera XS inert |
||
|
ng/ml |
Genauigkeit |
ng/ml |
Genauigkeit |
|
|
0,5 |
2,28 |
455,7 |
0,57 |
113,5 |
|
1 |
-1,04 |
-104,4 |
0,93 |
93,0 |
|
5 |
2,43 |
48,5 |
5,42 |
108,5 |
|
10 |
56,2 |
56,2 |
9,13 |
91,3 |
|
50 |
26,63 |
53,3 |
50,24 |
100,6 |
|
100 |
76,39 |
76,4 |
92,77 |
92,8 |
|
500 |
588,74 |
117,7 |
497,04 |
99,4 |
|
1,000 |
965,46 |
96,5 |
1,010,36 |
101,0 |
Im Rahmen einer Studie wurden die Empfindlichkeit, die Quantifizierungsleistung und der Carry-over-Effekt eines edelstahlbasierten UHPLC-Systems im Vergleich zu einem bioinerten UHPLC-System bei der hochempfindlichen LC-MS-Analyse von Oligonukleotiden untersucht. Bei Verwendung des bioinerten Systems ließen sich in allen Aspekten Verbesserungen erzielen, sodass die Vorteile einer metallfreien Flusslinie bei der Analyse von Verbindungen mit metallaffinen Gruppen eindeutig nachgewiesen werden konnten. Diese Studie zeigt den Nutzen einer Nexera XS inert in Kombination mit einer metallfreien Trennsäule für eine genaue Charakterisierung und Qualitätskontrolle von therapeutischen Oligonukleotiden.
Bibliografie/Weitere Informationen
- C10G-E097 – Oligonucleotide Therapeutics Solution Guide, Shimadzu Corporation, 2022 / First Edition: Oktober 2022
/