Schnellerer Durchsatz. Gemeinsam.
Neue optimierte Lösung für die Analyse von Immunsuppressiva mittels LC-MS/MS
Mr. Mikaël Levi, Alsachim / Reagent Kit Business Unit
Um steigenden Anforderungen hinsichtlich Zeit und Ressourcen gerecht zu werden, benötigen Chemielabore anwenderfreundliche Lösungen mit kürzeren Durchlaufzeiten und geringeren Kosten pro Probe bei gleichzeitiger Einhaltung der immer strenger werdenden gesetzlichen Vorschriften. Dank jüngster Arbeiten von Alsachim mit Geräten und Software von Shimadzu gibt es jetzt eine optimierte Hochdurchsatz-Analyselösung, die noch am selben Tag Ergebnisse für die therapeutische Arzneimittelüberwachung von Immunsuppressiva liefert. Die Lösung vereint Flüssigchromatographie und Tandem-Massenspektrometrie (LC-MS/MS) mit automatisierter Probenvorbereitung und einem speziellen Reagenzienkit.
Das therapeutische Drug Monitoring (TDM) ist eine interdisziplinäre Wissenschaft mit dem Ziel, die Einflussfaktoren der Dosis-Wirkungs-Beziehung zu verstehen und dieses Wissen zu nutzen, um die Arzneimittelbehandlung zu optimieren (d. h. die Wirksamkeit zu maximieren und die Nebenwirkungen zu minimieren). In vielen klinisch-chemischen Laboratorien ist die Zahl der Medikamente, die einer routinemäßigen Arzneimittelüberwachung bei Patienten unterzogen werden, begrenzt. Dazu gehören Antibiotika, Antiepileptika, Antidepressiva, Digoxin, Methotrexat und verschiedene Immunsuppressiva. Dies spiegelt die Notwendigkeit wider, Medikamentenklassen mit eng gefasstem therapeutischen Index, etablierten Konsequenzen bei Unter- oder Überdosierung, einer definierten Beziehung zwischen der Konzentration im Blut und der klinischen/toxischen Wirkung, erheblichen Schwankungen bei und zwischen Einzelpersonen und bei Medikamenten mit bewährter Wissensbasis für die klinische Behandlung zu überwachen.[1–3]
In den meisten Laboren kommen bei der therapeutischen Arzneimittelüberwachung überwiegend automatisierte Immunoassays zum Einsatz. Diese können jedoch aufgrund von Kreuzreaktivität der aktiven Metaboliten zu verzerrten Ergebnissen führen. Diese Komplikation kann durch die chargenspezifische Heterogenität der Antikörper oder der Reagenzienqualität, durch Hochdosiseffekte und bei einigen Immunoassays durch hohe Kosten pro Analyse noch verstärkt werden.[4]
Da sich die Präzisionsmedizin mehr und mehr zu einem Ansatz für die individuelle Behandlung von Patienten entwickelt, d. h. für die Behandlung einer bestimmten Krankheit und unter Berücksichtigung der individuellen Variabilität von Genen, Umwelt und Lebensstil, dürfte die therapeutische Arzneimittelüberwachung künftig einen noch größeren Einfluss auf die Dosisanpassung haben. Schon jetzt steigen durch diesen neuen Anwendungsbereich für die therapeutische Arzneimittelüberwachung die Anzahl der zu untersuchenden Proben und der Druck, die Durchlaufzeiten zu verkürzen. Erschwerend kommt hinzu, dass die im Mai 2022 in Kraft getretenen europäischen Vorschriften für die In-vitro-Diagnostik (IVDR) eingehalten werden müssen, was den Bedarf an zertifizierten und regelkonformen Analyselösungen, einschließlich Geräten und Reagenzien, drastisch erhöht hat.
In diesem Artikel stellen wir eine zeitsparende und vollständig richtlinienkonforme Komplettlösung für die Analyse von Immunsuppressiva mit hohem Durchsatz vor, die sich durch eine Kombination aus Flüssigchromatographie und Tandem-Massenspektrometrie (LC-MS/MS) mit automatisierter Probenvorbereitung und einem speziellen Reagenzienkit auszeichnet.
LC-MS/MS zur therapeutischen Arzneimittelüberwachung
Flüssigchromatographie (LC) unter Verwendung von Ultraviolett- (UV), Photodiodenarray- (PDA) und Fluoreszenzdetektionssystemen (FLD) wird seit mehreren Jahrzehnten in der therapeutischen Arzneimittelüberwachung eingesetzt. Trotz der Leistungsfähigkeit der Ultra-Hochleistungs-Flüssigkeitschromatographie (UHPLC) [5–7] sind solche Nachweismethoden jedoch in Bezug auf ihre Spezifität begrenzt, was oft zu langen Probenzyklen und geringer Empfindlichkeit führt, da viele Verbindungen keine natürlichen Chromophore oder Fluorophore aufweisen.[1]
Die Massenspektrometrie (MS) gilt heute als eine der wichtigsten Techniken für Labore zur Bereitstellung robuster Plattformen mit hoch selektiver und empfindlicher Detektion.[8] Die Fähigkeit der MS zur Entwicklung von Assays für einzelne Arzneimittel („laborentwickelte Tests“ [LDTs] bzw. „laboreigene“ Assays) und zur Multiplexierung von Analytpanels schafft neue Möglichkeiten und erweitert gleichzeitig die Zahl der Arzneimittelassays. Durch die Erhöhung der Zahl der Arzneimittelassays, die Erleichterung des Zugangs zu dieser Technologie und den Einsatz neuartiger Blutprobenstrategien, darunter die Entnahme von Mikroproben für die therapeutische Arzneimittelüberwachung bei Kindern oder die Entnahme von Proben zu Hause,[9–12] eignet sich die therapeutische Arzneimittelüberwachung außerdem hervorragend zur Förderung des wachsenden Bereichs der personalisierten Medizin.

Automatisierte Handhabung und Vorbereitung von Proben
Biologische Flüssigkeiten besitzen eine hoch komplexe Matrix, die eine Herausforderung für die Analytik darstellen, da endogene und exogene Komponenten in der MS zu verbindungs- und systemspezifischen Effekten führen. Bei allen Protokollen zur Probenvorbereitung und -verarbeitung muss sorgfältig darauf geachtet werden, die Effekte der Matrix zu neutralisieren. Matrixeffekte können zu isobarer Interferenz, Verstopfung durch Partikel und Suppression oder Verstärkung von Ionen führen, wodurch ein Unterschied in der Signalintensität im Vergleich zur sauberen Standardlösung beobachtet wird (im Vergleich zu einem matrixangepassten Standard).[13–16]
Bei der Elektrospray-Ionisierung ist die Ionensuppression auf eine Veränderung der Tröpfchenbildung und der Oberflächenspannung zurückzuführen, die die Effizienz des Ladungstransfers beeinflusst. Nicht flüchtige Verbindungen wie Blutphospholipide, Salze, ungeladene Matrixbestandteile, Reagenzienverunreinigungen und Arzneimittel/Metaboliten können bekanntermaßen zu einer Suppression oder Verstärkung von Ionen führen.[17] Um die Auswirkungen der Matrixeffekte auf bioanalytische Assays zu reduzieren, stehen dem Analytiker mehrere Strategien zur Verfügung. Eine der wichtigsten Techniken ist die Verwendung geeigneter und validierter interner Standards (IS), vor allem von mit stabilen Isotopen markierten Analoga (SIL-ISTD), zur Korrektur von Ionensignaländerungen und Handhabungsfehlern in Probenvorbereitungsprotokollen. Bei vielen Analysen müssen jedoch aufgrund der hohen Variabilität der Konzentrationen endogener Moleküle zwischen verschiedenen Patienten und auch bei einzelnen Patienten die Proben mithilfe von Extraktions- oder Aufreinigungstechniken wie Flüssig-Flüssig-Extraktion (LLE), Festphasenextraktion (SPE) oder Proteinfällung (PPT) gereinigt werden. Jede Technik muss im Hinblick auf die Leistungsfähigkeit der Analyse charakterisiert werden, um ein akzeptables Maß an Genauigkeit und Präzision zu erreichen und gleichzeitig auch die Effizienz und Rückgewinnung der Extraktion, die Anwenderfreundlichkeit und die Kosten pro Probe zu berücksichtigen.
Bei Analysen mit hohem Durchsatz können automatisierte Systeme bei der Konzeption der Probenvorbereitungsmethode von großem Nutzen sein. Liquid-Handling-Robotersysteme mit mehreren Pipetten, beispielsweise Hamilton Microlab Star, können einfache oder komplexe Probenvorbereitungsprotokolle mit einer großen Anzahl von Proben verarbeiten.
Immunsuppressiva
Immunsuppressiva dienen dazu, die Aktivität des Immunsystems zu reduzieren, um die Abstoßung von Transplantaten zu verhindern. Die am häufigsten eingesetzten Arzneimittel sind Calcineurin-Inhibitoren, Cyclosporin und Tacrolimus sowie die mTOR-Inhibitoren Sirolimus und Everolimus. Die zirkulierenden Konzentrationen dieser Substanzen sollten innerhalb eines engen therapeutischen Fensters gehalten werden, da eine Überdosierung zu schwerwiegenden Toxizitäten und langfristiger Morbidität führen kann, während eine Unterdosierung eine Abstoßung des Transplantats zur Folge haben kann.[3] Da Immunsuppressiva zu einer hohen pharmakokinetischen Variabilität zwischen einzelnen Patienten führen, ist die therapeutische Arzneimittelüberwachung inzwischen ein etablierter Ansatz zur Minderung der mit einer Organtransplantation verbundenen Risiken.
Für die TDM von Immunsuppressiva stehen mehrere handelsübliche Immunassays zur Verfügung. Alle Immunassays weisen jedoch im Vergleich zu LC-MS/MS-Methoden einen systematischen positiven Fehler auf.[18] Trotz der Verfügbarkeit automatisierter Immunassays ist jeder Test auf einen Analyten pro Test beschränkt, obwohl in vielen klinischen Umgebungen bei einzelnen Patienten mehrere Immunsuppressiva angewendet werden.[1,19] Nachfolgend wird eine neue rationalisierte und automatisierte LC-MS/MS-Methode für die routinemäßige Analyse zur therapeutischen Arzneimittelüberwachung von Immunsuppressiva beschrieben.
Kombination einzelner Lösungen
Um den Anforderungen der Hochdurchsatzanalyse gerecht zu werden, wurde ein DOSIMMUNE™-Kit (Alsachim) an die robotergestützte Flüssigkeitsverarbeitung angepasst. Dieses validierte und CE-IVD-zertifizierte Kit mit manueller Probenvorbereitung enthält alle erforderlichen Reagenzien (mobile Phasen, Puffer, mit stabilen Isotopen markierte interne Standards) und Verbrauchsmaterialien (Säulen) für die Überwachung von Immunsuppressiva in Vollblut mittels LC-MS/MS. Die Kalibrator- und Kontrollgefäße können direkt in ein Roboter-Rack positioniert werden (Abbildung 1). Im Vergleich zur manuellen Pipettierung haben Liquid-Handling-Systeme jedoch ein größeres Totvolumen, das nicht genutzt werden kann. Daher wurde der Inhalt von je zwei Gefäßen jedes Kalibrators und jeder Kontrolle vor dem Einsetzen in die Racks vereinigt. Durch diese Vorgehensweise können die Kalibratoren und Kontrollen eine ganze Woche lang verwendet werden, bevor sie ausgetauscht werden müssen.
Um die Anzahl der Verbrauchsmaterialien und Protokollschritte zu reduzieren, wurde eine IS-Lösung direkt mit dem Extraktionspuffer gemischt. Das Gemisch kann dann in einem Reservoir oder über eine Lösungsmittelabgabeeinheit dispensiert werden.
Die Arbeitsabläufe des Liquid-Handling-Systems wurden optimiert, um eine möglichst kurze Vorbereitungszeit zu erreichen und gleichzeitig die mit dem manuellen Protokoll erzielte Leistung beizubehalten. Die meisten Maßnahmen konzentrierten sich dabei auf den Schritt der Resuspension des Blutes. Denn Vollblut sinkt aufgrund der Schwerkraft ab, was zu einer Trennung von Plasma und Erythrozyten führt. Um präzise Ergebnisse zu erzielen, sollten die Proben beim Testen homogen sein. Daher wurde jede Probe kurz vor dem Testen resuspendiert. Es wurde ein spezielles Protokoll mit mehreren Sequenzen der Probenaufnahme/-abgabe unter Verwendung der Funktion des Roboters zur Nachverfolgung der Probenhöhe entwickelt. Mithilfe dieses Protokolls konnten Proben mit Volumina von 0,5 bis 5 ml und Hämatokritwerten von 30 bis 70 % erfolgreich homogenisiert werden und zwar mit einer Zeitersparnis von 60 % im Vergleich zu ähnlichen Protokollen, die in den Laboren eingesetzt wurden. Die Zeit-/Geschwindigkeitsparameter für das Vortexen und Zentrifugieren wurden ebenfalls optimiert und die Vorgänge so weit wie möglich parallelisiert. Schlussendlich erfolgt die Probenvorbereitung einer kompletten 96-Well-Platte (Leerwert + 6 Kalibratoren, 4 Kontrollen und 85 Proben) innerhalb von 45 Minuten. Im Vergleich zu herkömmlichen Roboterlösungen für die Analyse von Immunsuppressiva entspricht dies einer Reduzierung der Vorbereitungszeit um 50 %.
Immunsuppressiva sind komplexe hydrophobe Verbindungen, die bekanntermaßen in der LC zu Carry-over-Effekten führen. Daher ist eine effiziente Reinigung des Injektionssystems zwischen den Proben unerlässlich, um die Genauigkeit der Ergebnisse zu gewährleisten. Das neue Nexera X3 LC-System (Shimadzu) bietet verbesserte Spülfunktionen, die den Zeitaufwand für die Reinigung des Nadelinneren drastisch reduzieren. Dadurch konnte die LC-MS/MS-Zykluszeit von 2,1 auf 1,5 Minuten (von Injektion zu Injektion) reduziert werden. In Anbetracht der Anzahl der zu analysierenden Proben bedeutet diese Reduzierung um 30 % eine erhebliche Verbesserung der Durchlaufzeit.
Auswertung und Validierung
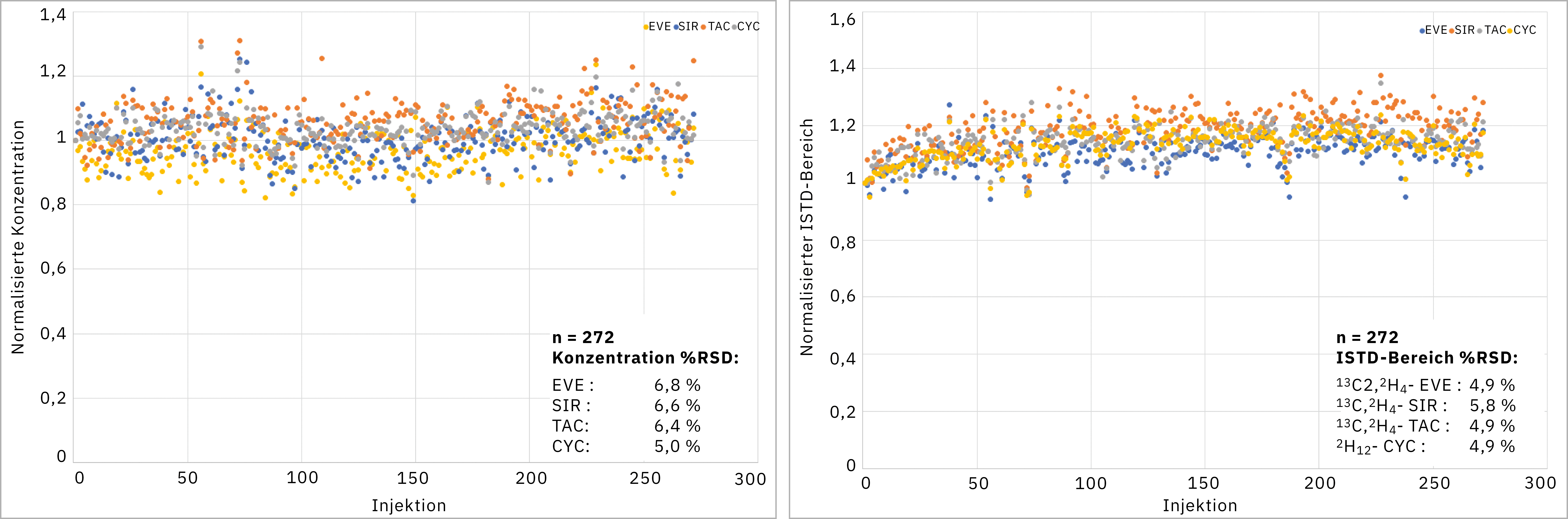
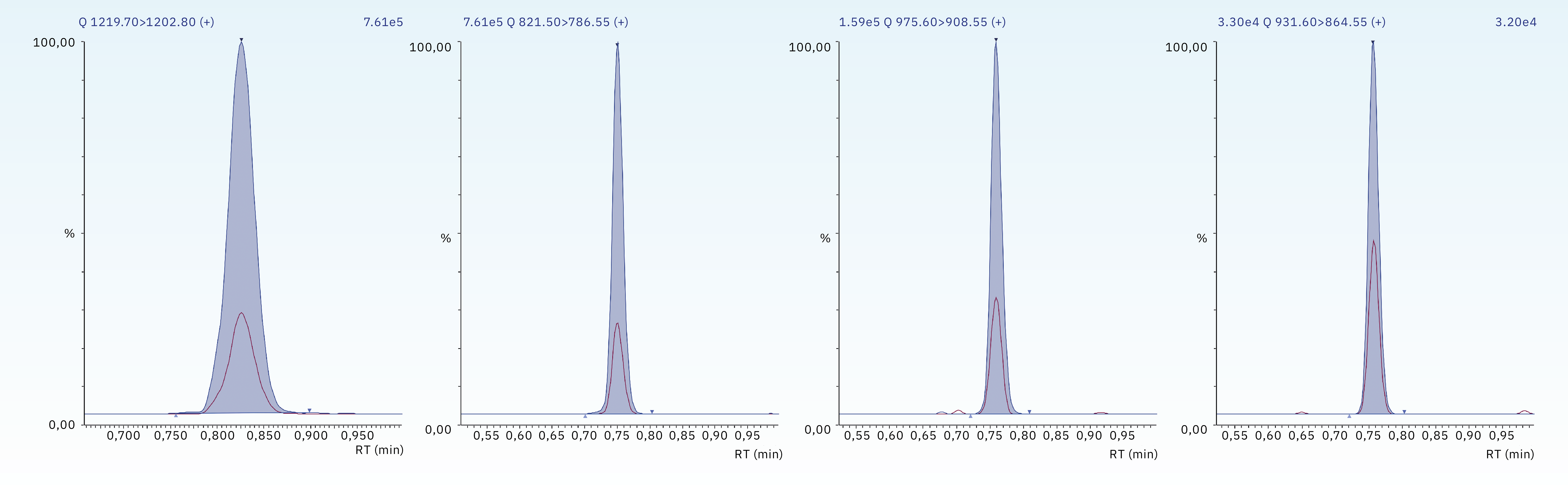
Zur Beurteilung der Präzision und Stabilität der Lösung wurden nacheinander drei Platten vorbereitet, die nur dieselbe Kontrolle in niedrigen bis mittleren Konzentrationen (Tacrolimus, Sirolimus und Everolimus mit etwa 8 µg/l, Cyclosporin A mit etwa 145 µg/l) als unbekannte Probe enthielten. Die erste Platte enthielt Kalibratoren und Kontrollen; die anderen Platten enthielten Kontrollen. Die Platten wurden in der gleichen Reihenfolge analysiert. Schließlich wurden 272 Datenpunkte für die drei Platten ermittelt. In Abbildung 2 sind die gemessenen Konzentrationen für alle Verbindungen und die gemessene IS-Peakfläche dargestellt. Die relative Standardabweichung der Konzentrationen oder der Peakflächen lag deutlich unter dem üblicherweise akzeptierten Wert von 15 %. Dadurch wurde nachgewiesen, dass die Kalibrierung stabil war (ohne dass eine Kalibrierung für jede Platte erforderlich war), dass die Präzision der Probenvorbereitung ausgezeichnet war und dass die Reagenzien im Roboter-Rack stabil waren. Ein charakteristisches Chromatogramm einer solchen niedrig bis mittel konzentrierten Kontrollprobe ist in Abbildung 3 dargestellt.
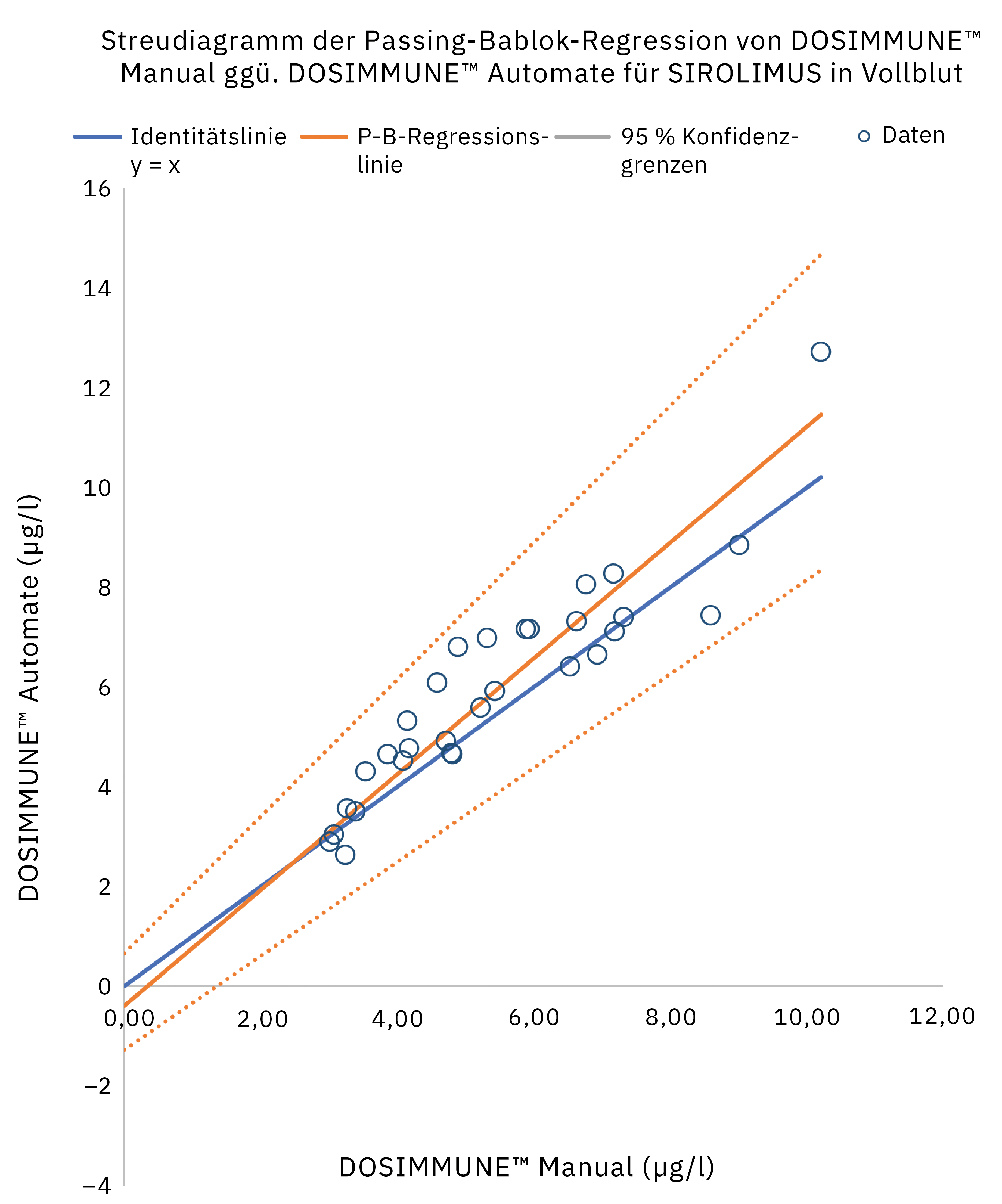
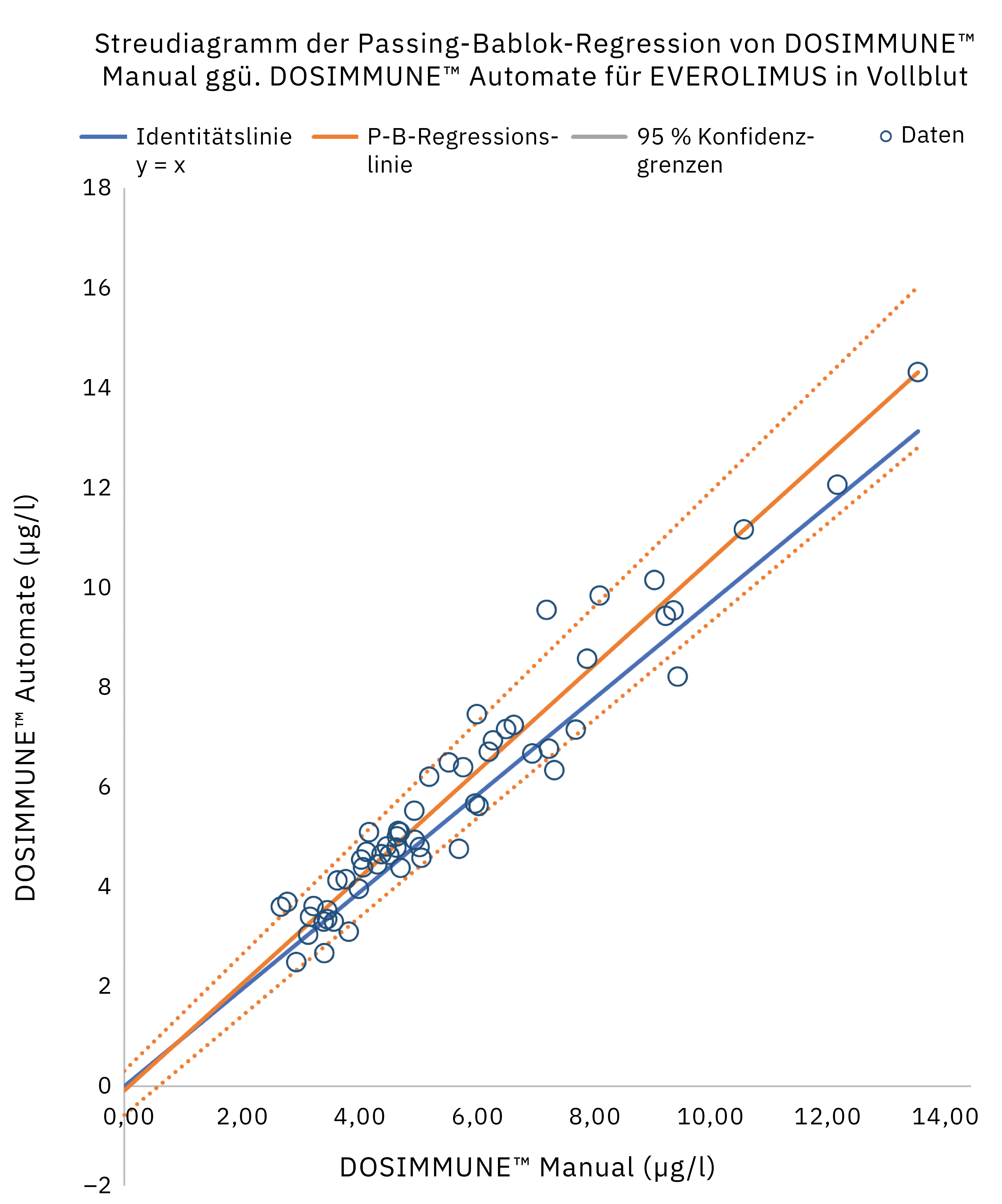
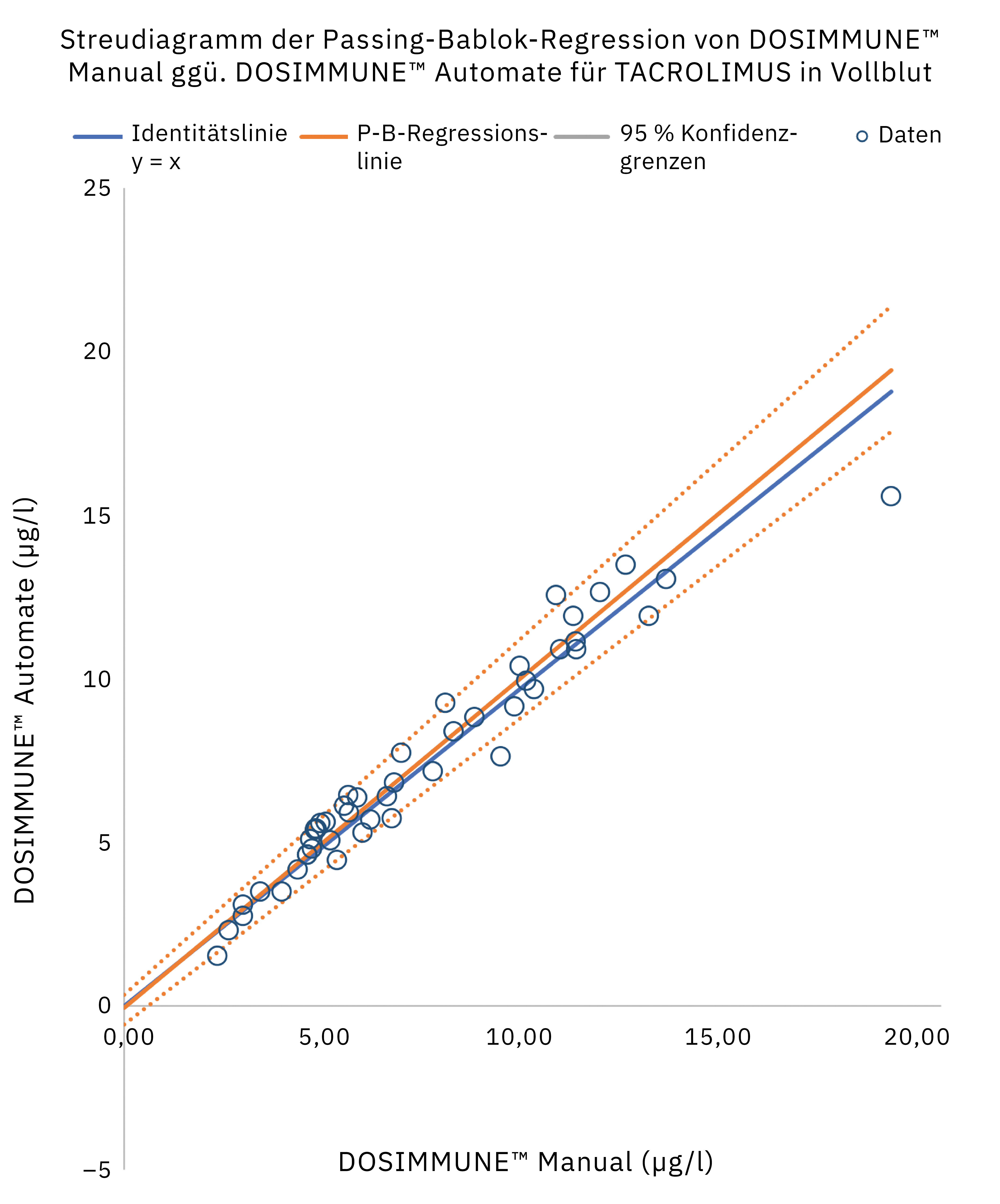
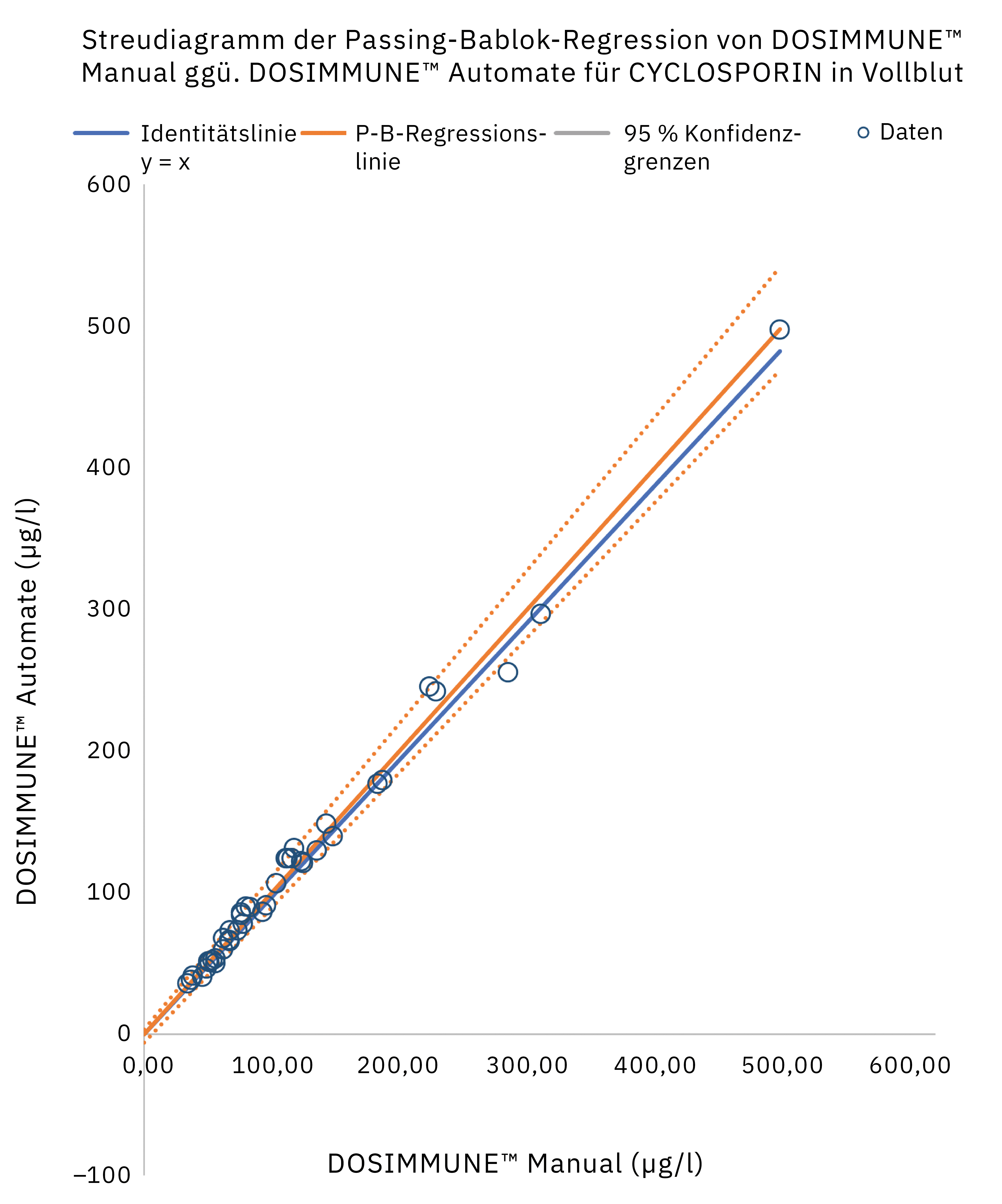
Die Methode einschließlich der Probenvorbereitung wurde gemäß den internationalen Richtlinien für bioanalytische Methoden (ICH M10[20], CLSI C62-A[21]) validiert. Darüber hinaus wurde die klinische Leistung bewertet, indem die Ergebnisse, die bei echten Patientenproben mit manueller Vorbereitung erzielt wurden, mit denen des automatisierten Protokolls verglichen wurden. Die statistische Analyse (Passing-Bablok-Regression, Bland-Altman-Diagrammstatistiken) ergab, dass die Methoden sehr gut übereinstimmen und vergleichbar sind. In Abbildung 4 sind die Ergebnisse der Passing-Bablok-Regressionsanalyse dargestellt.
Durchsatz und Konformität
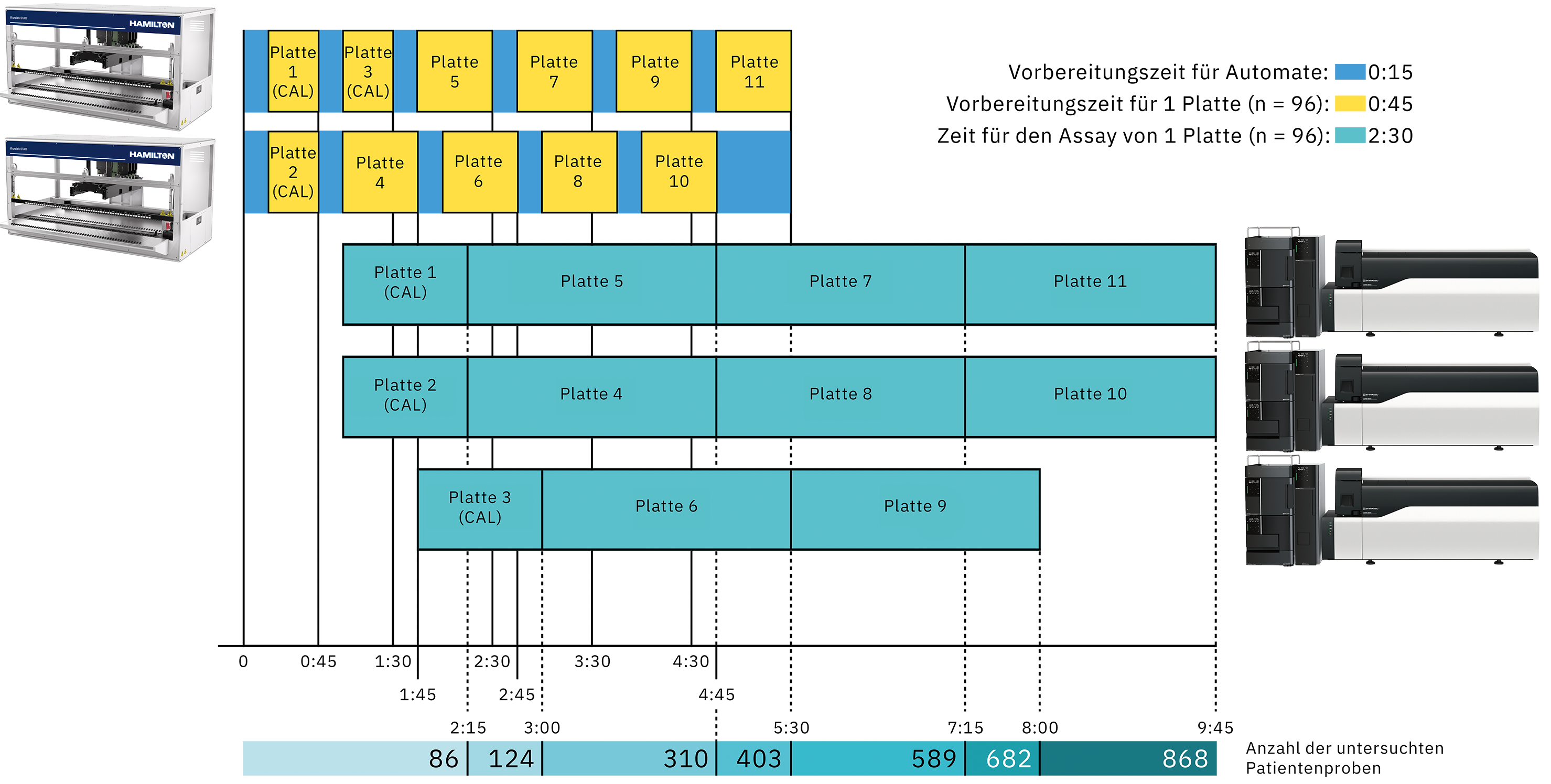
Dank der schnellen Probenvorbereitung und der reduzierten Zeit, die für die Analyse einer vollständigen Platte erforderlich sind, kann der Durchsatz des Labors durch viele verschiedene Konfigurationen angepasst werden. Durch die Anpassung der Anzahl der Liquid-Handling- und LC-MS/MS-Systeme lassen sich 300 bis fast 900 Patientenproben in weniger als 10 Arbeitsstunden analysieren. In Abbildung 5 ist ein Beispiel für eine vorgeschlagene Konfiguration zur Erreichung eines sehr hohen Durchsatzes dargestellt.
Neben der analytischen Optimierung wurde auch der Informationsfluss untersucht, um diesen an die Systemgeschwindigkeit anzupassen. Das Liquid-Handling-System generiert automatisch die Arbeitsliste durch das Scannen der Patientenröhrchen. Diese Liste wird direkt im richtigen Format in die Shimadzu LabSolutions Software für LC-MS exportiert. Mit nur wenigen Klicks lässt sich die Sequenz für die Probenanalyse erstellen. LabSolutions Insight ermöglicht eine effiziente und einfache Datenverarbeitung. Unter Verwendung adaptiver Markierungsregeln schlägt die Software einen Review-by-Exception vor, bei dem die Daten hervorgehoben werden, die vom Analytiker geprüft werden müssen. Eine doppelte Datenvalidierung ist möglich, bevor die Ergebnisse über CSV-Dateien oder eine bidirektionale HL7-Verbindung an das Laborinformationssystem gesendet werden.
Alle Geräte und Software, die mit dieser zeitsparenden Lösung in Zusammenhang stehen, sind CE-IVD-zertifiziert. Das DOSIMMUNE™-Kit wurde ebenfalls CE-IVD-zertifiziert mit manueller oder automatischer Probenvorbereitung.
Abschließend lässt sich sagen, dass es nun eine effiziente und zeitsparende neue Methode für die Hochdurchsatzanalyse von Immunsuppressiva gibt, bei der eine optimierte und vollständig richtlinienkonforme Kombination von Instrumenten, Reagenzien und Software zum Einsatz kommt.
Bibliografie/Weitere Informationen
- F. Saint-Marcoux, F.-L. Sauvage, P. Marquet. Anal. Bioanal. Chem 388 (2007) 1327–1349.
- J.E. Adaway, B.G. Keevil. J. Chromatogr. B 883–884 (2012) 33–49.
- P.J. Taylor, C.-H. Tai, M.E. Franklin, P.I. Pillans. Clin. Biochem. 44 (2011) 14–20.
- M. Vogeser, C. Seger. J. Chromatogr. B 883–884 (2012) 1–2.
- S. Barco, A. Zunino, A. D’Avolio, L. Barbagallo, A. Maffia, G. Tripodi, E. Castagnola, G. Cangemi. J. Pharm. Biomed. Anal. 138 (2017) 142–145.
- B. Toussaint, F. Lanternier, C. Woloch, D. Fournier, M. Launay, E. Billaud, E. Dannaoui, O. Lortholary, V. Jullien. J. Chromatogr. B 1046 (2017) 26–33.
- V. Mistretta, N. Dubois, R. Denooz, C. Charlier. Acta Clinica Belgica 69 (2014) 53–61.
- M. Himmelbasch. J. Chromatogr. B 883–884 (2012) 3–17.
- B.G. Keevil, J. Fildes, A. Baynes, N. Yonan. Ann. Clin. Biochem 46 (2009) 144–145.
- N. Yonan, R. Martyszczuk, A. Machaal, A. Baynes, B.G. Keevil. Clin. Transplant. 20 (2006) 221–225.
- W. Li, F.L.S. Tse. Biomed. Chromatogr. 24 (2010) 49–65.
- P.M. Edelbroek, J. Van der Heijden, L.M.L. Stolk. Ther. Drug. Monit. 31 (2009) 327–336.
- M. Vogeser, C. Seger. Clin. Chem. 56:8 (2010) 1234–1244.
- T.M. Annesley. Clin. Chem. 49:7 (2003) 1041–1044.
- B.K. Matuszewski, M.L. Constanzer, M. Chavez-Eng. Anal. Chem. 70 (1998) 882–889.
- B.K. Matuszewski, M.L. Constanzer, M. Chavez-Eng. Anal. Chem. 75 (2003) 3019–3030.
- S.T. Wu, D. Schoener, M. Jemal. Rapid. Commun. Mass Spectrom. 22 (2008) 2873–2881.
- W. Tszyrsznic, A. Borowiec, E. Pawlowska, R. Jaswiec, D. Zochowska, I. Bartlomiejczyk, J. Zegarska, L. Paczek, M. Dadlez. J. Chromatogr. B 928 (2013) 9–15.
- F. Aucella, V. Lauriola, G. Vecchione, G.L. Tiscia, E. Grandone. J. Pharm. Biomed. Anal. 86 (2013) 123–126.
- ICH guideline M10 on bioanalytical method validation EMA/CHMP/ICH/172948/2019.
- CLSI. Liquid Chromatography-Mass spectrometry Methods – Approved Guideline. CLSI document C62-A. Wayne, PA: Clinical and Laboratory Standards Institute; 2014.