
Schnellere Bestimmung von Chloramphenicol in Honig
Neues Verfahren kombiniert DPiMS-8060 mit dem LCMS-8060NX für schnellere Messungen
Dr. Gerasimos Liapatas, Dr. Manos Barmpounis, N.Asteriadis SA, Athens, Greece
Dr. Konstantinos M. Kasiotis, Dr. Kyriaki Machera, Laboratory of pesticides´ Toxicology, Benaki Phytopathological Institute, Kifissia, Greece
Für die Untersuchung von Honig auf Rückstände von Chloramphenicol wurde eine neuartige, von Shimadzu entwickelte APCI-Quelle eingesetzt. Das innovative Verfahren basiert auf dem Prinzip der Probe-Elektrospray-Ionisations-Massenspektrometrie (PESI-MS) und markiert einen bedeutenden Fortschritt in der LC-MS-Analyse, da sie den Einsatz einer Analysesäule überflüssig macht. Mit dieser Methode lassen sich eine Bestimmungsgrenze von 1,0 ng/g und eine erheblich kürzere Messzeit von zwei Minuten pro Probe erzielen – das ist zehnmal schneller als herkömmliche Verfahren.
Honig ist ein Naturprodukt, das weltweit zu Ernährungs- und Kosmetikzwecken hergestellt wird. Dabei wird es unter anderem auch von empfindlichen Bevölkerungsgruppen wie Kleinkindern, Schwangeren und älteren Menschen verzehrt. Bei der Honigproduktion kommen üblicherweise Xenobiotika wie Pestizide und Antibiotika zum Einsatz, um die Bienenvölker vor Infektionen zu schützen. So wird zur Behandlung von Bienenlarven beispielsweise das Breitbandantibiotikum Chloramphenicol eingesetzt. Chloramphenicol hat jedoch toxische und dosisunabhängige Nebenwirkungen auf empfindliche Personen und der Einsatz bei Nutztieren für die Lebensmittelproduktion, einschließlich Honigbienen, ist gesetzlich reguliert.[1]
Die Entwicklung eines robusten und selektiven Verfahrens für die Analyse von Honig kann herausfordernd sein, da Honig etwa 200 verschiedene Substanzen enthält, darunter Zucker, Wasser und andere Substanzen wie Proteine, organische Säuren, Vitamine, Mineralstoffe, Pigmente, Phenole und große Mengen flüchtiger Stoffe. Die chemische Zusammensetzung von Honig ist sehr variabel, denn sie hängt von den Pflanzen, von denen die Bienen den Nektar gesammelt haben und von weiteren Faktoren wie Umweltveränderungen und den Herstellungsprozessen ab.[3,4]
Herkömmliche Methoden zur Untersuchung von Honig auf Chloramphenicol-Rückstände nutzen die Elektrospray-Ionisation (ESI). Bei diesen Methoden ist der pH-Wert des wässrigen Teils der mobilen Phase für die Ionisierung des Analyten entscheidend. Die Theorie der Elektrospray-Ionisation besagt, dass der Analyt in der mobilen Phase in vorionisierter Form vorliegen sollte, sodass der pH-Wert des wässrigen Teils angepasst werden muss. Der organische Teil der mobilen Phase spielt eine ebenso wichtige Rolle – nicht nur wegen der Auswirkungen auf die Retentionszeit, sondern auch bei der Ionisierung, da er die Oberflächenspannung der Tröpfchen, die sich im Inneren der Quelle bilden, stark beeinflusst. Bedauerlicherweise sind ESI-Methoden mitunter sehr zeitaufwendig, sodass Forscher nun eine Ionenquelle entwickelt haben, um das Verfahren zu beschleunigen. Die neue Quelle kombiniert die hohe Selektivität des LCMS-8060NX im MRM-Modus mit der hohen Messgeschwindigkeit des neuen DPiMS-8060 von Shimadzu und macht den Einsatz einer Analysesäule überflüssig.
Nachweis von Chloramphenicol-Rückständen in Honig
Die Probe-Elektrospray-Ionisations-Massenspektrometrie (PESI-MS) wendet ähnliche Prinzipien wie die ESI an. Die mobile Phase wird durch eine kleine Menge Lösungsmittel ersetzt, in dem die Probe enthalten ist: Diese wird anschließend auf eine Kunststoffplatte übertragen. Die ESI-Kapillare wird durch eine Metallnadel ersetzt, die in die Lösung eintaucht; die Ionisierung findet also an der Nadel statt. Folglich sind der pH-Wert und der organische Gehalt des Lösungsmittels von höchster Bedeutung bei der PESI-MS – aus denselben Gründen auch bei der herkömmlichen ESI.
Die Probe-Elektrospray-Ionisations-Massenspektrometrie (PESI-MS) wurde 2007 von Hiraoka et al. entwickelt. Dabei wird die herkömmliche ESI-Kapillare durch eine Metallnadel ersetzt und die Flüssigchromatographie entfällt. Die Metallnadel wird bei der PESI-MS von einem motorbetriebenen System auf einer vertikalen Achse nach oben und unten bewegt. In der untersten Position berührt die Nadelspitze die Oberfläche der Probenflüssigkeit und bindet eine kleine Menge davon. In der höchsten Position wird eine Hochspannung an der Nadel angelegt und die mit der Nadelspitze aufgenommene Probe zerstäubt.[2] Der Probenextrakt wird direkt in das Massenspektrometer eingebracht und im MRM-Modus analysiert.
Bei der PESI-Quelle strömt die mobile Phase nicht mehr konstant in das Massenspektrometer. Stattdessen wird eine kleine Menge des Extrakts auf eine Probenplatte aus Kunststoff gegeben. Der Analytiker öffnet die Quelle, legt die Platte ein und schließt die Quelle wieder (Abbildungen 1 und 2). Das Gerät analysiert nun die Probe und der Analytiker fährt mit der nächsten Messung fort.
Im Rahmen der Entwicklung dieser PESI-MS-Methode wurden drei Lösungsmittel getestet: 100 % Methanol; 50 % Wasser – 50 % Methanol mit 10 mM Ammoniumformiat; und 50 % Wasser – 50 % Isopropanol mit 10 mM Ammoniumformiat und 0,2 % Ameisensäure. Bei Verwendung von Methanol als Lösungsmittel wurde kein Signal für Chloramphenicol und den internen Standard (IS) festgestellt. Im Vergleich zum Wasser-Methanol-Gemisch wurde mithilfe von Wasser-Isopropanol ein viermal stärkeres Signal erzielt. Mit dieser neuartigen Methode lassen sich eine Bestimmungsgrenze von 1,0 ng/g und erheblich kürzere Messzeiten von zwei Minuten pro Probe erzielen.

Wiederholbarkeit, Extraktionseffizienz und Matrixeffekt
Die Wiederholbarkeit der Messungen wurde durch dreifache Analyse einer mit Chloramphenicol und Chloramphenicol-d5 dotierten Probe untersucht. Zunächst war die prozentuale relative Standardabweichung (%RSD) bei Chloramphenicol (9,5 %) und dem IS (11,1 %) sehr hoch. Nach Zugabe eines deuterierten internen Standards reduzierte sich der %RSD-Wert um den Faktor 5 (1,7 % gegenüber 9,5 % und 11,1 %), was zeigt, dass sich die Wiederholbarkeit der PESI-MS-Messungen mit einem deuterierten internen Standard erheblich verbessern lässt.
Folgende Gründe könnten die vergleichsweise hohe relative Standardabweichung ohne Verwendung eines internen Standards erklären: Aufgrund der kleinen Menge des Extrakts in der Quelle (10 µl) kann es sein, dass sich dessen Konzentration selbst durch eine nur minimale Verdampfung des Lösungsmittels verändert. Zudem entnimmt die Nadel während der Messung einen Teil der Probe von der Platte. Dementsprechend verringert sich die Menge des Extrakts auf der Platte, sodass die Nadeloberfläche, die das Extrakt berührt, kleiner sein könnte. Schließlich besteht die Möglichkeit, dass sich im Lauf der Messung Spuren des Analyts und der Matrix an der Nadel akkumulieren, was zu einem insgesamt positiven oder negativen Bias führen kann. Möglicherweise sind die gleichzeitigen Auswirkungen aller vorgenannten Phänomene ursächlich für die hohe relative Standardabweichung.
Da bei der PESI-MS keine chromatographische Trennung erfolgt, können potenzielle Quellen der Ionenunterdrückung im Extrakt nicht mehr vom Analyten und vom internen Standard getrennt werden. Daher war es wichtig, den Matrixeffekt des vorgeschlagenen Vorbehandlungsprotokolls zu bestimmen. Dazu wurden eine an die Matrixzusammensetzung der Realprobe angepasste „Blank“-Probe (mit dem Analyten und dem internen Standard in Lösungsmittel rekonstituiert) und eine dotierte Probe mit einer Konzentration von 3 ng/g Honig hergestellt. Um den Matrixeffekt zu bewerten, wurden die Ergebnisse für beide Proben mit denen für die Standardlösung verglichen. Daraus ergab sich eine Extraktionseffizienz von 74 % für Chloramphenicol und 73 % für den internen Standard. Ein Vergleich der Ergebnisse für die „Blank“-Probe und die Standardlösung weist auf eine Wiederfindungsrate von 54 % für Chloramphenicol und 46 % für den internen Standard hin.
Probenvorbereitung
3 g der Probe wurden eingewogen, nach Zugabe einer geeigneten Menge IS-Lösung gevortext und 4 ml Acetonitril zugegeben. Anschließend wurde die Probe zwei aufeinanderfolgenden QuEChERS-Extraktionen unterzogen. 2 ml des endgültigen Extrakts wurden in einen Rundkolben gegeben und das Lösungsmittel unter einem leichten Stickstoffstrom bis zur Trockene verdampft. Anschließend folgte die Rekonstitution der Probe mit 1 ml von 10 mM Ammoniumformiat und 0,2 % Ameisensäure. 10 µl des resultierenden Extrakts wurden dann auf eine Flüssigprobenplatte transferiert und in die PESI-Quelle gegeben.
MS-Parameter und Datenverarbeitung
Für die Detektion von Chloramphenicol und des internen Standards wurde die negative Ionisierung angewendet. Zur Quantifizierung von Chloramphenicol wurde ein etablierter MRM-Übergang verwendet (321 > 257).[4] Die Kollisionsenergie (CE) für die Quantifizierung war auf 11 V optimiert. Zur Bestätigung wurde der MRM-Übergang 321 > 194 bei CE 18 V verwendet. Die entsprechenden Parameter für den internen Standard waren 326 > 262, CE 12 V für die Quantifizierung und 326 > 157, CE 18 V für die Bestätigung. Für die Analyse wurden 10 µl des Probenextrakts genommen, die Analysezeit betrug 0,3 min pro Probe und die Gesamtmesszeit weniger als zwei Minuten, einschließlich der Probenentnahme nach der Messung und dem Einbringen der nächsten Probe in die Quelle.
Die Massenspektrometrie-Parameter für die entwickelte Methode werden in Tabelle 1 beschrieben. Der größte Unterschied bei den MS-Parametern im Vergleich zu herkömmlichen LC-MS-Methoden ist die deutlich geringere Heizblocktemperatur (30 oC anstatt typischer Werte von ca. 250 oC) bei PESI-MS-Methoden.[6,7] Ein weiterer Unterschied zu herkömmlichen LC-MS-Methoden ist, dass vor der Messung des Analyten und des IS (Abbildung 4) jeweils ein Q3-Scan (m/z 10–2.000) im positiven und im negativen Modus stattfindet.
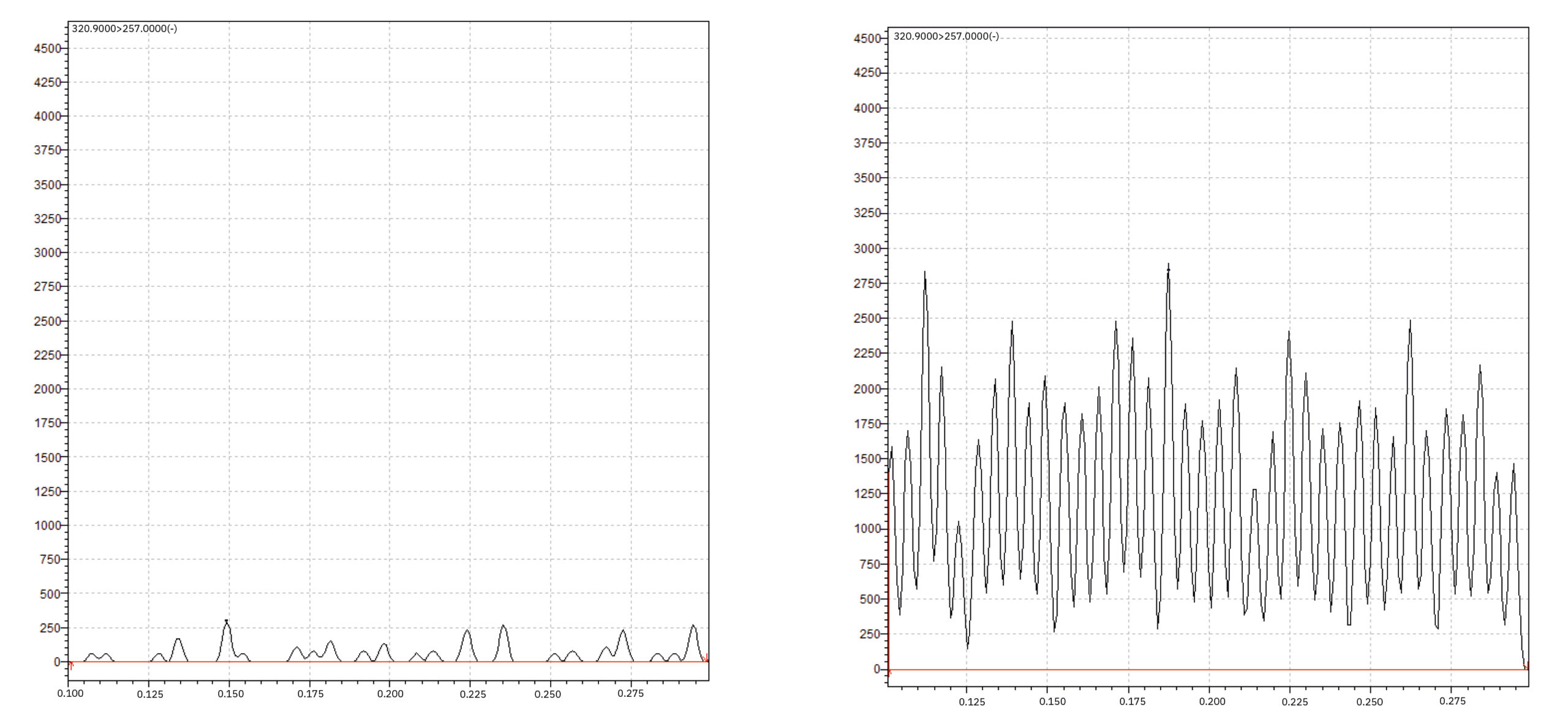
Es gibt zwei wichtige PESI-MS-Parameter, die in der „PESI MS Solution“-Software konfiguriert werden können: Die „Ionization outage time“ ist der Zeitraum, in dem die Nadel während der Messung in der Ionisierungsposition verweilt und die „Take sample outage time“ ist der Zeitraum, in dem sich die Nadel während der Messung in der Position der Probenentnahme befindet. Die Summe aus „Ionization outage time“ und „Take sample outage time“ ergibt den Bewegungszyklus der Sonde (Tabelle 2). Die Anwendung der PESI-MS-Methode führt zu einem vollkommen unterschiedlichen Rohdatenformat. Statt eines chromatographischen Peaks müssen jetzt mehrere Dutzend Peaks integriert werden. Jeder Peak entspricht einer spontanen Ionisierung durch die PESI-Nadel (Abbildung 5).
|
Typ |
Ereignis# |
+/- |
Verbindungsname m/z |
Zeit (0,000 min – 0,300 min) |
|
Q3 Scan |
1 |
+ |
10,0000:2000,0000 |
|
|
Q3 Scan |
2 |
– |
10,0000:2000,0000 |
|
|
MRM |
3 |
– |
CAP 320,9000 > 257,0000, 320. |
|
|
MRM |
4 |
– |
CAP d5 325,9000 > 262,0000, 3 |
|
|
MS Parameter |
Wert |
|
Desolvatisierungstemperatur |
250 °C |
|
Heizblocktemperatur |
30 °C |
|
Verweilzeit |
10 ms |
|
Ionisationsspannung |
2 kV |
|
Q1-Auflösung |
Einheit |
|
Q3-Auflösung |
Einheit |
|
MRM Chloramphenicol (Quantifizierung) |
321 > 257 |
|
MRM Chloramphenicol (Bestätigung) |
321 > 152 |
|
MRM Chloramphenicol d5 (Quantifizierung) |
326 > 262 |
|
MRM Chloramphenicol (Bestätigung) |
326 > 157 |
|
PESI-Parameter |
Wert |
|
Ionization outage time |
160 ms |
|
Take sample outage time |
50 ms |
Schnellere Analysen
Über die mögliche toxische Wirkung von Chloramphenicol-Rückständen in Honig hinaus ist die Kontrolle von Antibiotika generell ein Teil der weltweit wachsenden Bedenken über den unnötigen Einsatz antimikrobieller Substanzen in der Landwirtschaft. Denn dieser steht im Zusammenhang mit dem immer häufigeren Auftreten von Infektionen durch multiresistente Keime, die zukünftig immer häufiger sterblich verlaufen könnten, wenn nicht drastische Gegenmaßnahmen ergriffen werden.[5] Schnellere und einfachere Analysen können Hochdurchsatzlaboren weltweit dabei helfen, ihre kritische Arbeit für die Sicherheit und das Wohlergehen aller Menschen noch besser zu erfüllen.
Referenzen
- S. Rizzo, M. Russo, M. Labra, L. Campone, L. Rastrelli, Determination of Chloramphenicol in Honey Using Salting-Out Assisted Liquid-Liquid Extraction Coupled with Liquid Chromatography-Tandem Mass Spectrometry and Validation According to 2002/657 European Commission Decision, Molecules, 2020, 25, 3481–3494.
- K. Hiraoka, K. Nishidate, K. Mori, D. Asakawa, S. Suzuki, Development of probe electrospray using a solid needle, Rapid Commun. Mass Spectrom., 2007, 21, 3139–3144.
- P.M. Da Silva, C. Gauche, L.V. Gonzaga, A.C.O. Costa, R. Fett, Honey: Chemical composition, stability and authenticity, Food Chem., 2016, 196, 309–323.
- L. Campone, A.L. Piccinelli, I. Pagano, S. Carabetta, R. Di Sanzo, M. Russo, L. Rastrelli, Determination of phenolic compounds in honey using dispersive liquid-liquid microextraction, J. Chromatogr. A, 2014, 1334, 9–15.
- Tackling drug-resistant infections globally: Final report and recommendations: The review on antimicrobial resistance, chaired by J. O’Neill.
- P. Griffeuille, S. Duleaurent, S. Moreau, F. Saint-Marcoux, Driving under the influence of drugs: PESI for the measurement of illicit drugs in saliva, The column, 2021, 17, 13–17.
- P. Griffeuille, S. El Balkhi, S. Bodeau, F. Lamoureux, P. Marquet, S. Duleaurent, F. Saint-Marcoux, Ultrafast measurement of metformin in the clinical setting using Probe Electrospray Ionization Mass Spectrometry, J. Anal. Toxicol., 2022, 00, 1–7.


