Nährwertbestimmung und Betrugserkennung
Durch den kombinierten Einsatz von GC-2030 und GCMS-QP2020NX lassen sich bei der Analyse von Speiseölen mehr Informationen erfassen
Fotis Fotiadis, MSc Chemist, Dr. Manos Barmpounis, N. Asteriadis SA, Athen, Griechenland
Prof. Peter A. Roussos, Asimina-Georgia Karyda, MSc Agronomist, Dep. of Crop Science, Agricultural University of Athens
Die Gaschromatographie (GC) hat sich als Verfahren für die Detektion und Quantifizierung von Fettsäuren in Speiseölen bewährt – insbesondere in Kombination mit dem Flammenionisationsdetektor (GC-FID). Die Quantifizierung von Fettsäuren in Speiseölen ist nützlich, um den Nährwert der Öle zu bestimmen und Betrug aufzudecken – etwa, wenn ein hochwertiges Öl mit minderwertigeren Ölen gestreckt wurde. Das GC-FID-Verfahren hat jedoch gewisse Einschränkungen, die Forscher nun durch die ergänzende Anwendung von GC-MS für die Analyse von sechs Speiseölen überwinden konnten. Das kombinierte Verfahren kam anschließend noch zum Nachweis von Squalen in drei Proben zur Anwendung.
Die Reinheit von Speiseölen sicherstellen
Speiseöle mit einem hohen Anteil an einfach ungesättigten Fettsäuren (MUFA) und mehrfach ungesättigten Fettsäuren (PUFA) weisen einen hohen Nährwert auf. Diese Speiseöle haben einen positiven Effekt auf die menschliche Gesundheit und Entwicklung. So senken sie beispielsweise das Risiko, an kardiovaskulären Erkrankungen, Diabetes und Alzheimer zu erkranken, und unterstützen die Prävention und Behandlung von Krebs.[2]
Pflanzliche Fette und Fischfette sind grundsätzlich ungesättigt. Im Gegensatz dazu weisen die meisten tierischen Fette und viele verarbeitete Lebensmittel einen hohen Anteil an gesättigtem Fett auf. Der negative Effekt von gesättigten Fettsäuren (SFA) auf die Herzgesundheit ist gründlich erforscht [3] und viele Gesundheitsbehörden weisen darauf hin, dass der Verzehr von gesättigtem Fett zu den Risikofaktoren für die Ausbildung von Herz-Kreislauf-Erkrankungen gehört.[4] In mehreren Studien wurde zudem festgestellt, dass SFA zu Stress im endoplasmatischen Retikulum (ER) und zu Leberschäden führen können.
Betrugsfälle aufdecken
Vor allem mit Blick auf den korrekten Nährwert ist es daher wichtig, dass Verbraucher wissen, was sie kaufen. Die Verantwortung dafür obliegt in der Regel den staatlichen Stellen für Lebensmittelsicherheit und -kennzeichnung. Bei Speiseölen sind Aufsichtsbehörden häufig mit Betrugsfällen konfrontiert, in denen höherwertige Öle mit minderwertigeren gestreckt werden. Solche Fälle lassen sich häufig allein mit gründlichen Testverfahren aufdecken.
Die Gaschromatographie (GC) hat sich als Methode für die Detektion und Quantifizierung von Fettsäuren in Speiseölen bewährt – insbesondere in Kombination mit einem Flammenionisationsdetektor (GC-FID). Jedoch liefert GC-FID keine Informationen zur Identität der gemessenen Peaks, sodass zur Bestätigung der Messergebnisse Referenzstandards injiziert werden müssen.
Deshalb entschied sich eine Gruppe von Forschern, das häufig angewendete Verfahren mit einem neuen Verfahren zu vergleichen: der Gaschromatographie gekoppelt mit einem Massenspektrometer (GC-MS). Unterstützung bekamen sie von Shimadzu, dem Hersteller der Messgeräte, die für diesen Test erforderlich waren. Anschließend wurden insgesamt fünf verschiedene Arten von Speiseölen – Olivenöl, Oliventresteröl, Maiskeimöl, Hanföl und Sojaöl – sowohl mittels GC-FID als auch mittels GC-MS untersucht und analysiert.
Versuchsvorbereitung
Fettsäuren werden je nach Anzahl der Doppelbindungen als gesättigte Fettsäuren (SFA), einfach ungesättigte Fettsäuren (MUFA) und mehrfach ungesättigte Fettsäuren (PUFA) kategorisiert, die wiederum nach ihren spezifischen Bestandteilen unterteilt werden.[1]
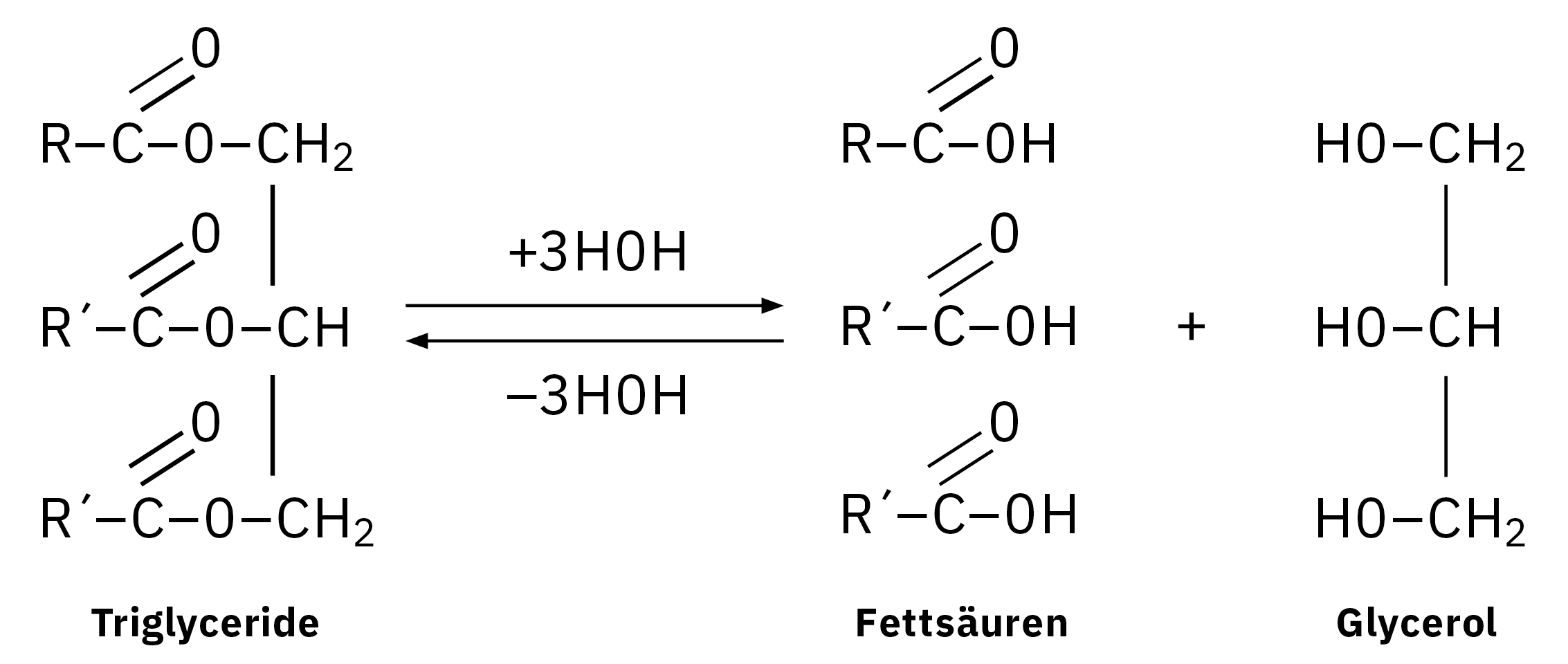
Für die Gaschromatographie müssen Fettsäuren derivatisiert werden, damit sie ausreichend volatil sind, um bei niedrigeren Temperaturen ohne thermische Zersetzung eluiert werden zu können. Dies setzt in der Regel eine Veresterung voraus. Methylester sind häufig untersuchte Derivate, die durch Methylierung hergestellt werden. Für das angewandte Verfahren werden die Esterbindungen hydrolisiert, um freie Fettsäuren freizusetzen, die zur Bildung von Fettsäuremethylester (FAME) transmethyliert werden. Das entsprechende FAME-Profil, das mittels GC festgestellt wird, bezeichnet man als Fettsäurezusammensetzung.
Für diesen Vergleichstest wurden FAME mittels Veresterung vorbereitet. Hinweis: Alle für die Probenvorbereitung verwendeten Chemikalien lagen analysenrein vor (> 98 %): Methanol, Heptan und Kaliumhydroxid. Als Nächstes wurden aliquote Teile der Probe von 1–2 g in einem Becherglas gefiltert. Sofern das Öl keine mit bloßem Auge sichtbaren Sedimente oder Suspensionen aufwies, war keine Filterung notwendig. Anschließend wurde 0,5 g des Öls in einem 10-ml-Reagenzglas abgewogen. Mit einer Pipette wurden der Probe 5 ml Heptan und 1 ml Kalilauge in Methanol zugesetzt. Das Reagenzglas wurde 30 Sekunden lang kräftig geschüttelt und anschließend 15 Minuten lang stehen gelassen. (Zentrifugation der Probe wäre ebenfalls eine Option gewesen.) Im Reagenzglas bildeten sich zwei Schichten. Von der oberen organischen Phase (Heptan) wurde anschließend 1 µl in das GC- bzw. GC-MS-Instrument injiziert.
Analytische Bedingungen: GC-FID
Gaschromatograph:
Shimadzu GC-2030 mit AOC-20i+s, Split-/Splitless-Injektor, FID
Kapillarsäule:
MEGA-10 (30 m × 0,25 mm ID, 0,25 µm Schichtdicke)
|
Parameter |
Werte |
|
Split-Injektor-Temperatur |
245 °C |
|
Split-Verhältnis |
200 |
|
FID-Temperatur |
245 °C |
|
FID-Luftstrom |
200 ml/min |
|
FID-Wasserstoff |
32 ml/min |
|
FID-Make-up-Gas |
24 ml/min |
|
Trägergas |
He |
|
Lineare Geschwindigkeit |
31,3 cm/sec |
|
Säulendurchfluss |
1,1 ml/min |
|
Ofentemperaturprogramm |
150 °C → 12 min |
|
Säule |
MEGA-10 |
Analytische Bedingungen: GC-MS
Gaschromatographie-Massenspektrometrie:
Shimadzu Nexis GCMS-QP2020NX mit AOC-30i+s, Split-/Splitless-Injektor
Kapillarsäule:
MEGA-WAX_MS (30 m × 0,25 mm ID, 0,25 µm Schichtdicke)
|
Parameter |
Werte |
|
Split-Injektor-Temperatur |
240 °C |
|
Split-Verhältnis |
200 |
|
Trägergas |
He |
|
Lineare Geschwindigkeit |
31,3 cm/sec |
|
Säulendurchfluss |
1,2 ml/min |
|
Acquisition-Modus |
Scan (40–500 m/z) m/z) |
|
lonenquellen-Temperatur |
220 °C |
|
Interface-Temperatur |
240 °C |
|
Ofentemperaturprogramm |
150 °C → 5 min |
|
Säule |
MEGA-WAX_MS |

Ergebnisse
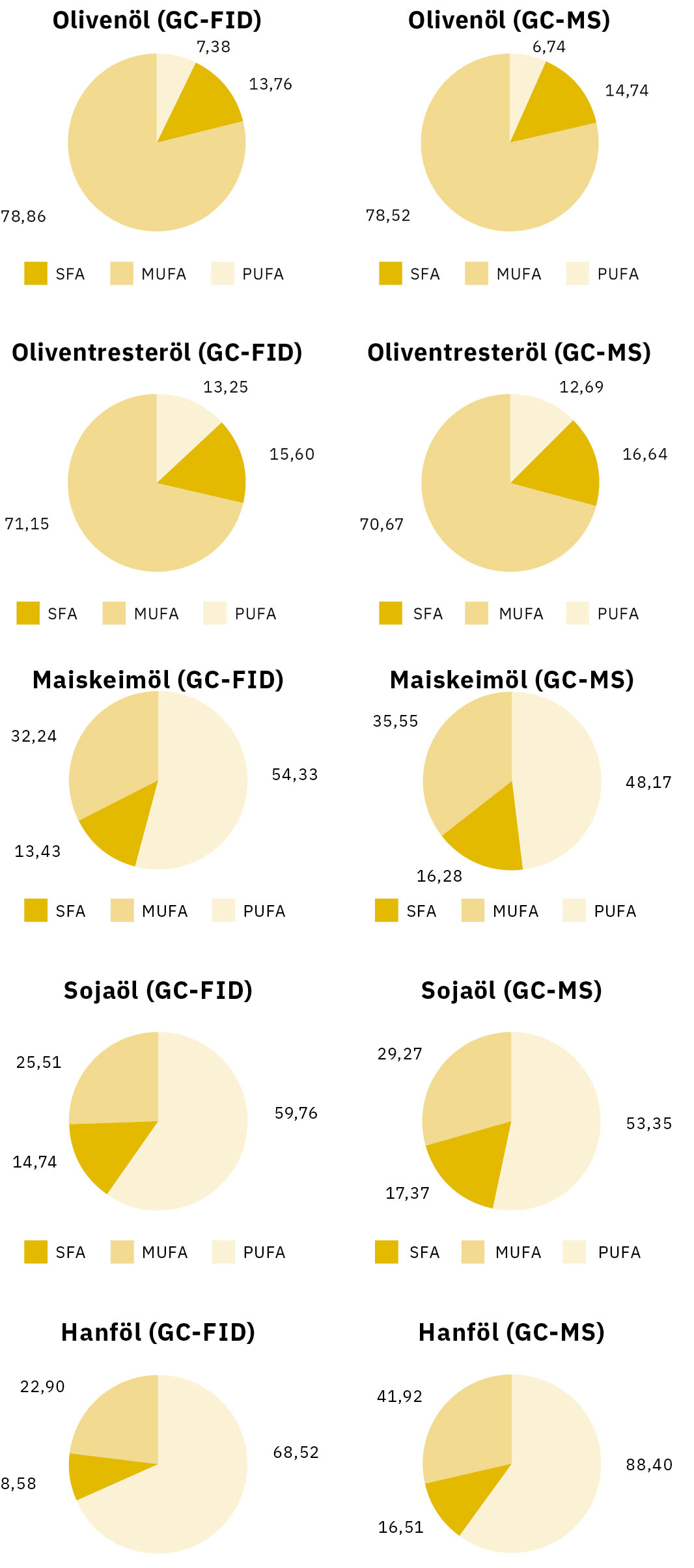
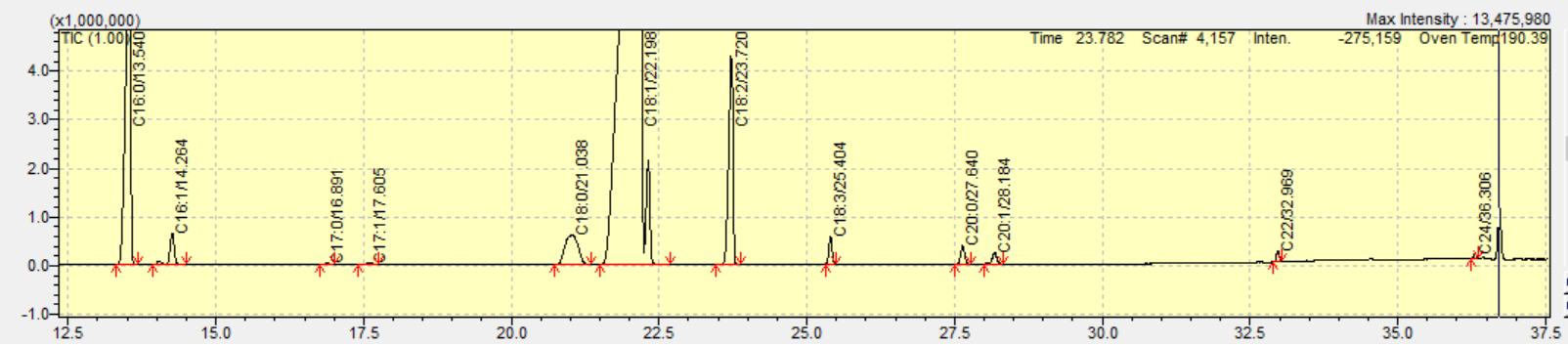
Der FAME-Gehalt wurde für jedes Speiseöl mittels GC-FID und GC-MS separat berechnet. Die Verhältnisse von einfach und mehrfach ungesättigten Fettsäuren wurden ebenfalls bestimmt. Ölsäure ist die wichtigste einfach ungesättigte Fettsäure in Speiseölen, während als mehrfach ungesättigte Fettsäuren hauptsächlich Linol- und Linolensäure vorkommen. Tabelle 3 und 4 führen die Gesamtergebnisse für den Anteil von Fettsäuren in fünf verschiedenen Speiseölen auf.
| Olivenöl | Oliventresteröl | Maiskeimöl | Sojaöl | Hanföl | |||||||
| FAME | GC- Fläche (%) |
GC-MS- Fläche (% TIC) |
GC- Fläche (%) |
GC-MS- Fläche (% TIC) |
GC- Fläche (%) |
GC-MS- Fläche (% TIC) |
GC- Fläche (%) |
GC-MS- Fläche (% TIC) |
GC- Fläche (%) |
GC-MS- Fläche (% TIC) |
|
| C14:0 | 0,013 | – | – | 0,02 | 0,012 | 0,04 | 0,024 | 0,11 | – | 0,05 | |
| C16:0 | 11,060 | 11,72 | 12,604 | 13,22 | 11,286 | 13,64 | 10,644 | 12,29 | 6,126 | 7,33 | |
| C16:1 | 0,938 | 0,98 | 1,049 | 1,12 | 0,136 | 0,16 | 0,087 | 0,11 | 0,166 | 0,18 | |
| C17:0 | 0,041 | 0,04 | 0,066 | 0,06 | 0,064 | 0,07 | 0,080 | 0,10 | 0,054 | 0,06 | |
| C17:1 | 0,073 | 0,08 | 0,091 | 0,10 | 0,036 | 0,03 | 0,053 | 0,05 | 0,022 | 0,03 | |
| C18:0 | 2,429 | 2,68 | 2,625 | 2,97 | 1,969 | 2,36 | 3,871 | 4,73 | 2,254 | 2,78 | |
| C18:1 | 77,291 | 76,74 | 69,477 | 68,76 | 31,808 | 34,92 | 25,117 | 28,66 | 22,374 | 25,67 | |
| C18:2 | 6,470 | 6,00 | 12,207 | 11,65 | 52,594 | 46,40 | 52,955 | 46,87 | 49,416 | 45,28 | |
| C18:3 | 0,764 | 0,59 | 0,733 | 0,69 | 1,011 | 0,92 | 5,894 | 5,38 | 17,534 | 15,95 | |
| C20:0 | 0,424 | 0,50 | 0,483 | 0,58 | 0,425 | 0,55 | 0,448 | 0,48 | 0,836 | 1,10 | |
| C20:1 | 0,313 | 0,35 | 0,363 | 0,45 | 0,338 | 0,44 | 0,189 | 0,33 | 0,651 | 0,77 | |
| C22:0 | 0,125 | 0,21 | 0,199 | 0,25 | 0,147 | 0,22 | 0,479 | 0,68 | 0,400 | 0,59 | |
| C24:0 | 0,058 | 0,11 | 0,103 | 0,13 | 0,174 | 0,25 | 0,159 | 0,22 | 0,168 | 0,21 | |
| 100,000 | 100,000 | 100,000 | 100,000 | 100,000 | 100,000 | 100,000 | 100,000 | 100,000 | 100,000 | ||
| Tabelle 3: Fettsäuregehalt (%) in Olivenöl, Oliventresteröl und Maiskeimöl | Tabelle 4: Fettsäuregehalt (%) in Soja- und Hanföl | ||||||||||
Auffällig ist, dass sich die mittels GC-FID erlangten Ergebnisse nicht unmittelbar mit den Ergebnissen der GC-MS für alle Proben vergleichen lassen. Wir stellen fest, dass der gemessene SFA-Gehalt beim GC-MS-Verfahren höher war als bei GC-FID. Beispielsweise ergab die Untersuchung der fünf Speiseöle mittels GC-MS einen höheren Gehalt an Palmitinsäure. Umgekehrt wurden beim GC-FID-Verfahren höhere PUFA-Verhältnisse (Linol-, Linolensäure) festgestellt. Daraus wird gefolgert, dass die GC-MS-Analyse von FAME unabhängig vom Probentyp zu einer Überschätzung des SFA-Gehaltes führt.
Verhältnis von MUFA zu PUFA
Das Verhältnis von Öl- zu Linolsäure bzw. von Öl- zu Linolensäure wurde in allen fünf Speiseölen untersucht (Tabelle 5). Die beiden Verfahren ergeben signifikant unterschiedliche Ergebnisse für das Verhältnis von MUFA (Ölsäure) zu PUFA (Linol- und Linolensäure). Die Abweichungen bei der Peakfläche spiegelten sich auch in den Verhältnissen der Fettsäuren wider. Grund dafür ist, dass der Gehalt der PUFA (Linol-, Linolensäure), der im Nenner der entsprechenden Bruchrechnungen steht, bei der GC-MS-Analyse unterschätzt wird. Die kleinste Differenz zwischen den beiden Methoden in Bezug auf das Verhältnis von Öl- zu Linolensäure fand sich bei Olivenöl und Oliventresteröl. Die Peakflächen dieser Fettsäuren waren so groß, dass die Auswirkungen auf das Verhältnis beim GC-FID- und GC-MS-Verfahren geringfügiger ausfielen.
|
Ölsäure/ |
Ölsäure/ |
|||
| SPEISE-ÖLE | GC- Verhältnis |
GC-MS- Verhältnis |
GC- Verhältnis |
GC-MS- Verhältnis |
| Olivenöl | 11,95 | 12,79 | 101,30 | 130,09 |
| Oliventresteröl | 5,69 | 5,89 | 94,75 | 99,89 |
| Maiskeimöl | 0,60 | 0,75 | 31,65 | 38,09 |
| Sojaöl | 0,47 | 0,61 | 4,26 | 5,33 |
| Hanföl | 0,45 | 0,57 | 1,28 | 1,61 |
SFA – MUFA – PUFA
Der Anteil an SFA, MUFA und PUFA in den fünf Speiseölen wurde miteinander verglichen. Für die Gruppe der SFA wurden Peaks von Palmitin- und Stearinsäure, für die Gruppe der MUFA ein Peak von Ölsäure und für die Gruppe der PUFA die Summe der Peakflächen von Linol- und Linolensäure gewählt.
Die Werte für den MUFA-Gehalt in Olivenöl und Oliventresteröl waren beim GC-FID- und beim GC-MS-Verfahren identisch. Der hohe Anteil an Ölsäure in diesen Proben (> 65 %) eliminierte die Abweichungen bei den SFA- und den PUFA-Werten. Dies war ein Unterschied zu den restlichen Proben, wo die Prozentwerte signifikante Abweichungen aufwiesen. Mit dem GC-MS-Verfahren wurde ein deutlich höherer SFA-Gehalt (Palmitin- und Stearinsäure) gemessen.
Die Auswertung der Ergebnisse
In dieser Studie wurden fünf Speiseölproben sowohl mittels GC-FID als auch mittels GC-MS analysiert. Der Vergleich der quantitativen Ergebnisse beider Verfahren ergab, dass GC-FID trotz der Entwicklung neuer Messgeräte weiterhin das Referenzverfahren für die quantitative Analyse von Fettsäuren ist.
Dennoch hat sich das GC-MS-Verfahren für die Analyse von Speiseölen eindeutig als nützlich erwiesen. Insbesondere durch die Kombination der hohen Leistung des GC-2030 bei der Zielanalyse mit der hohen Empfindlichkeit des GCMS-QP2020NX zur Erfassung von Strukturinformationen für eine große Anzahl von Verbindungen in jeder Probe konnten die Forscher zeigen, wie viel mehr Daten sich erfassen ließen.
Zusammenfassend lässt sich sagen: Mittels GC-FID lassen sich die Mengen bei bekannten Peaks eindeutig bestimmen, während die hohe Empfindlichkeit der GC-MS die Detektion weiterer Verbindungen für unbekannte Peaks und somit ein gründlicheres Screening der Proben ermöglicht.
Der Mehrwert des GC-MS-Verfahrens
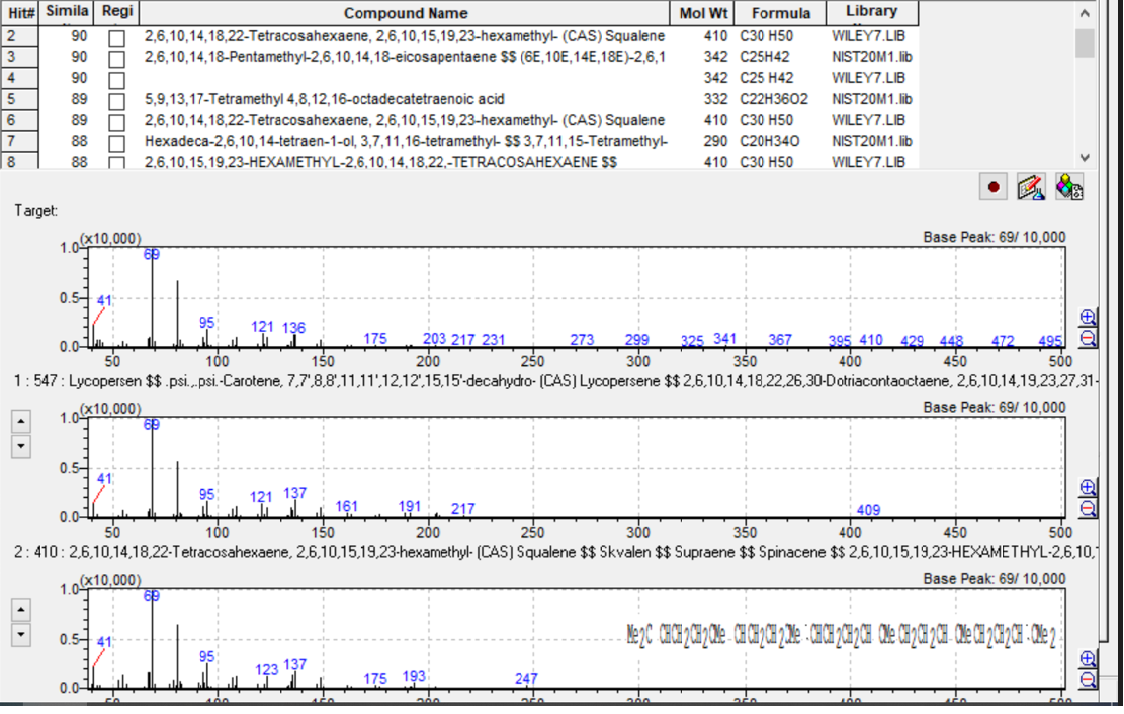
Um diese Schlussfolgerung zu belegen, nutzten die Forscher GC-MS-Daten zur Identifizierung von Squalen in drei Proben. Squalen ist ein natürlich vorkommendes Triterpen und dient als biochemischer Vorläufer von Sterinen. Es wurde zuerst in Hai-Lebertran festgestellt und hat nachweislich einen signifikanten medizinischen, therapeutischen und kosmetischen Nutzen.[5] Obwohl Squalen nicht zu den Fettsäuren zählt, entschieden die Forscher, das GC-MS-Verfahren anzuwenden, um dessen Nährwert in den untersuchten Speiseölen zu ermitteln.
Das Massenspektrum von Squalen wurde im Masse-zu-Ladung-Verhältnis von 40–500 m/z gemessen. Nach der Identifikation der am häufigsten vorkommenden und typischsten Ionen unter Scan-Bedingungen wurde die Technik des Selected Ion Monitoring (SIM) angewendet.
In drei der untersuchten Speiseöle (Olivenöl, Oliventresteröl, Maiskeimöl) konnte Squalen in unterschiedlicher Konzentration festgestellt werden. Die Bestimmung von Squalen mittels GC-MS erfolgte über die Retentionszeit; zur Bestätigung der Strukturformel wurden die Datenbanken NIST-20 und Wiley-7 herangezogen. Die Datenbanksuche nach dieser Zielverbindung ergab einen Ähnlichkeitsindex von 90 %. Auch das Vorhandensein von m/z:69 als Ziel-Ion und von m/z:81, m/z:41 als Referenzionen zur selben Retentionszeit bestätigte den Nachweis von Squalen.
Durch Ergänzung von GC-FID mit GC-MS konnte neben der Bestimmung von Fettsäuren auch bestätigt werden, dass Olivenöl die wichtigste Squalenquelle unter den Speiseölen ist. Oliventresteröl wies einen geringeren Gehalt auf; dieser fiel in Maiskeimöl noch niedriger aus. In Hanf- und Sojaöl wurde gar kein Squalen festgestellt.
Genauere Ergebnisse durch kombinierte Verfahren
In dieser Studie konnten die Forscher nachweisen, dass GC-FID für die Analyse von Fettsäuren in Speiseölen am besten geeignet ist. Die Integration von Total Ion Chromatograms (TIC) lieferte hingegen keine zuverlässigen Ergebnisse. Obwohl GC-FID eine sehr hohe Leistung bei der quantitativen Analyse erzielt, lässt sich damit lediglich eine sehr kleine Gruppe von Verbindungen feststellen. Im Rahmen dieser Studie konnte deshalb auch nachgewiesen werden, dass sich durch die ergänzende Anwendung von GC-MS ein breiteres Spektrum an Verbindungen detektieren lässt. Dieser zusätzliche Verfahrensschritt kann schnell und ohne großen Aufwand durch Nutzung der NIST-Datenbank durchgeführt werden, wie beim anschließenden Nachweis von Squalen gezeigt werden konnte.

Weiterführende Literatur
[1] Tingting Zhu, Xiao-Ting Lu, Zhao-Yan Liu and Hui-Lian Zhu, 26 July 2022 Sec. Nutritional Epidemiology, “Dietary linoleic acid and the ratio of unsaturated to saturated fatty acids are inversely associated with significant liver fibrosis risk: A nationwide survey Front. Nutr.”.
[2] Jasmin Kharazmi-Khorassani, Roshanak Ghafarian Zirak, Hamideh Ghazizadeh, Reza Zare-Feyzabadi, Sara Kharazmi-Khorassani, Sharzad Naji-Reihani-Garmroudi, Elham Kazemi, Habibollah Esmaily, Ali Javan-Doust, Hamed Banpour, Maryam Mohammadi-Bajgiran, Mohamad reza Besharatlou, Gordon A. Ferns, Mohammad Hashemi, and Majid Ghayour-Mobarhan, Acta Biomed. 2021; 92(2), “The role of serum monounsaturated fatty acids (MUFAs) and polyunsaturated fatty acids (PUFAs) in cardiovascular disease risk”.
[3] Lee Hooper, Nicole Martin, Oluseyi F. Jimoh, Christian Kirk, Eve Foster, Asmaa Abdelhamid S., 21 August 2020, The Cochrane Database of Systematic Reviews, “Reduction in saturated fat intake for cardiovascular disease”.
[4] https://www.efsa.europa.eu/en/efsajournal/pub/1461 European Food Safety Authority, 25 March 2010, “Scientific Opinion on Dietary Reference Values for fats, including saturated fatty acids, polyunsaturated fatty acids, monounsaturated fatty acids, trans fatty acids, and cholesterol”.
[5] Suzanne M. Budge, Christopher Barry, MethodsX. 2019; 6: 15–21, “Determination of squalene in edible oils by transmethylation and GC analysis”.