Mit Licht gegen Krebs
Neue Ansätze in der photodynamischen Therapie
Using light to beat cancer
New approaches in photodynamic therapy
Dr. Daniel Obitz, Ruhr-Universität Bochum
Eine alternde Bevölkerung und zunehmende Umweltverschmutzung sorgen dafür, dass Krebserkrankungen zunehmen. Durch Mutationen kommt es hierbei zum unkontrollierten Zellwachstum und zur Bildung von Tumoren. Klassische Therapien sind zum Beispiel die operative Entfernung des betroffenen Gewebes oder die Abtötung durch ionisierende Strahlung. Ein neuartiger Ansatz besteht in der photodynamischen Therapie.
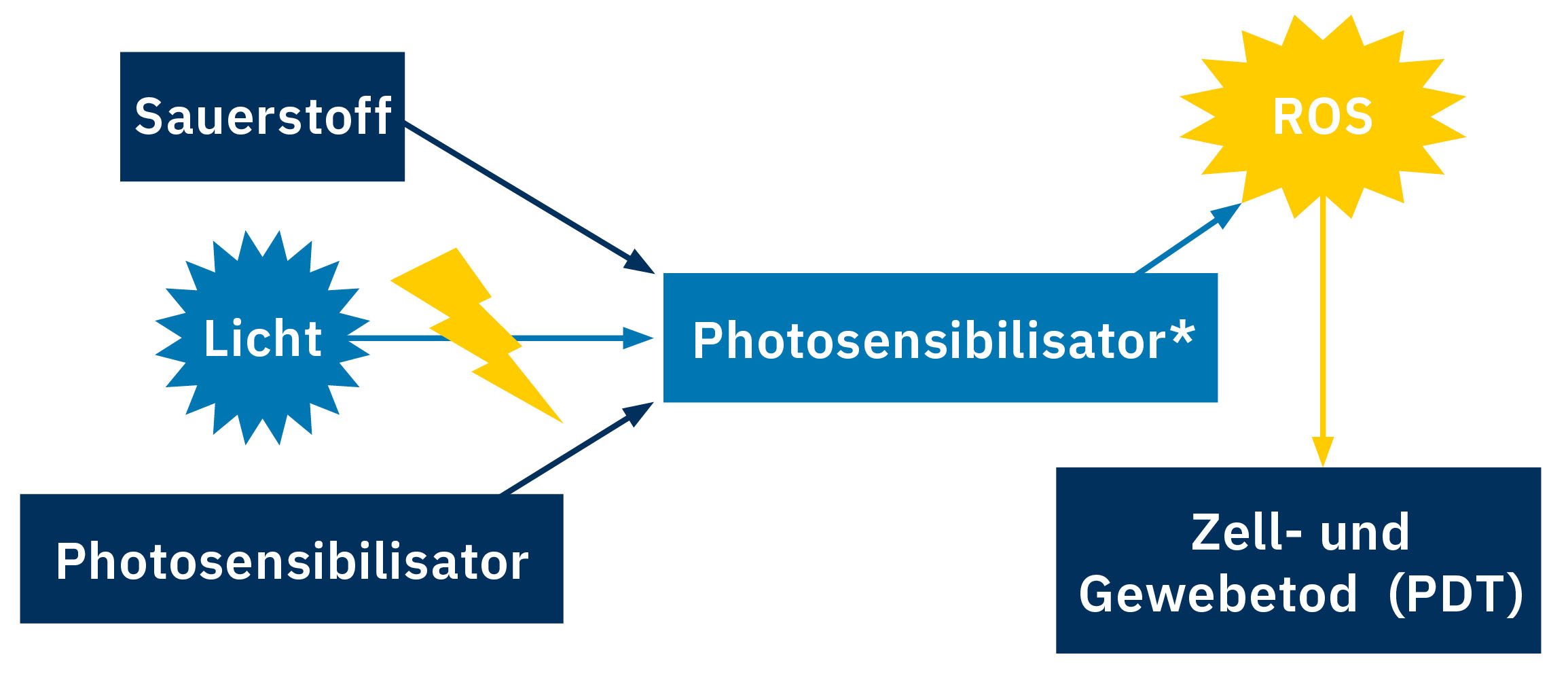
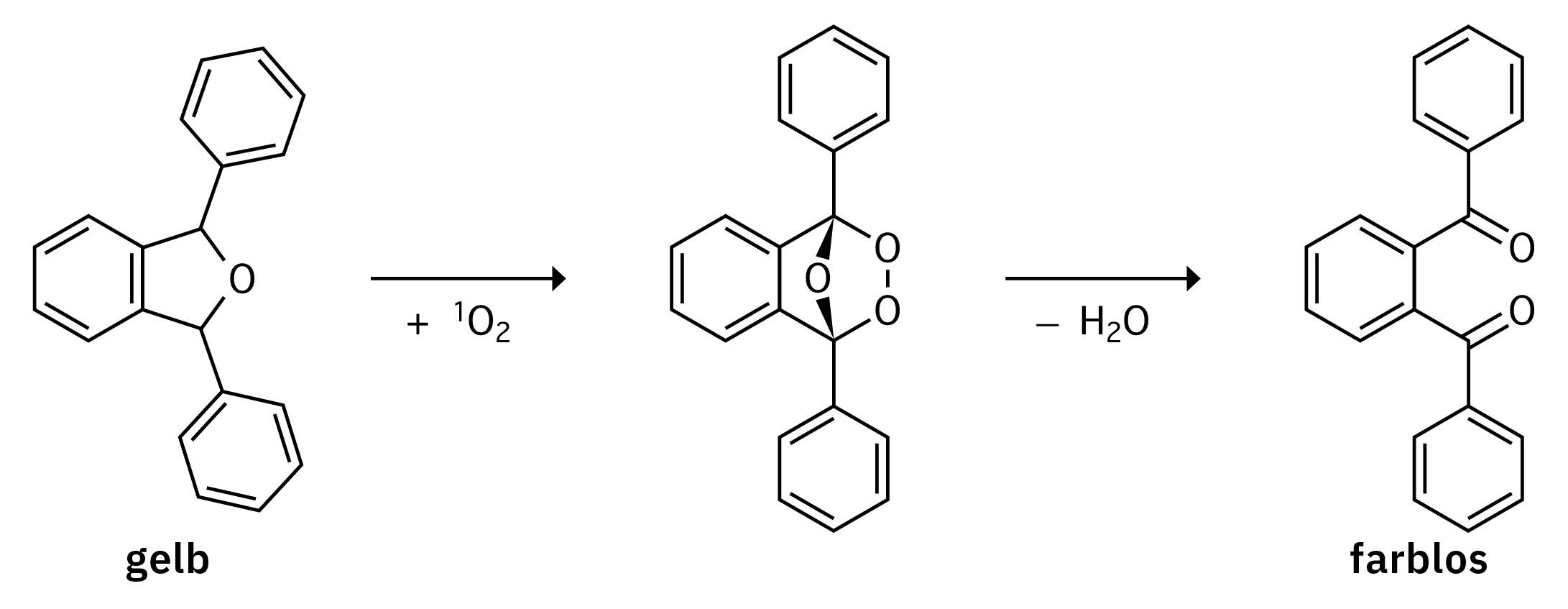
Krebszellen mithilfe von Licht zerstören: Die photodynamische Therapie (PDT) gilt als eine aussichtsreiche Alternative zu den klassischen Ansätzen in der Krebstherapie. Dabei wird ein – ohne Lichteinwirkung möglichst nicht toxischer – Photosensibilisator verwendet, der mit Licht einer spezifischen Wellenlänge angeregt und dadurch aktiviert wird. Dieser reagiert zusammen mit dem Sauerstoff im Tumorgewebe zu reaktiven Sauerstoffspezies (ROS), die zum Zell- bzw. Gewebetod im Tumorgewebe führen und somit den Tumor bekämpfen können (Abbildung 1). Ziel der Forschung in der Arbeitsgruppe von Prof. Dr. Nils Metzler-Nolte an der Ruhr-Universität Bochum ist die Entwicklung von neuen Photosensibilisatoren für die PDT.
Auf der Suche nach der richtigen Verbindung
Um eine Vorauswahl an aussichtsreichen Verbindungen zu erhalten, werden vor den aufwendigen Zellkulturexperimenten Tests der Verbindungen in Lösung durchgeführt (Abbildung 2):
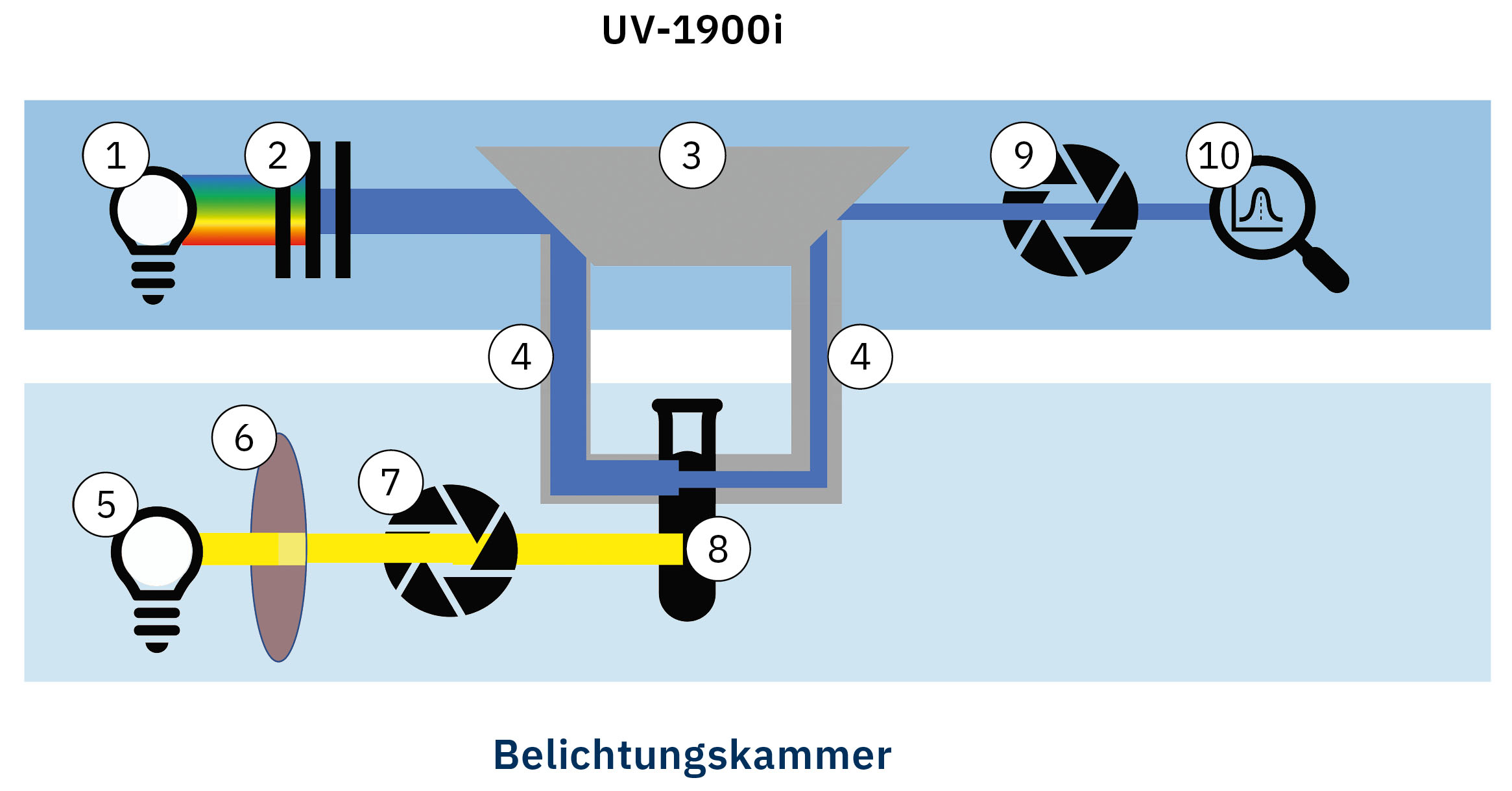
Abbildung 2: Schematischer Aufbau des Experiments, bestehend aus UV-Vis Spektrometer und Belichtungskammer
1: D2- und WI-Lampe
2: Monochromator
3: Kopplungsoptik für Lichtwellenleiter
4: Lichtwellenleiter
5: Xe-Lampe
6: Longpassfilter
7: Lampen-Shutter
8: Probe (Bildung von ROS)
9: Detektor-Shutter
10: Photodiode
Für die Messung der Absorptionsspektren wird ein Shimadzu UV-1900i UV-Vis-Spektrometer verwendet. Das Licht einer Deuterium- oder Halogenlampe (1) wird durch einen Monochromator (2) in monochromatische Strahlung zerlegt und über eine spezielle Optik (3) in einen Lichtwellenleiter (4) eingekoppelt.
Die untersuchte Verbindung wird zusammen mit einer Substanz, die mit reaktiven Sauerstoffspezies (ROS) reagiert, gelöst (8). Im Anschluss wird die Lösung mit einer Xenon-Gasentladungslampe (5) mit einem spezifischen Longpassfilter (6) beleuchtet. Die Belichtungszeit wird über einen elektronischen Shutter (7) geregelt.
Nach Abschluss der Belichtung wird der Lampen-Shutter geschlossen und das Absorptionsspektrum gemessen. Ein weiterer Shutter (9) schützt die empfindliche Photodiode (10) des Spektrometers vor Beschädigung durch intensives Streulicht während der Belichtung der Probe und wird nur während der Messung geöffnet.
Überwachung und Steuerung
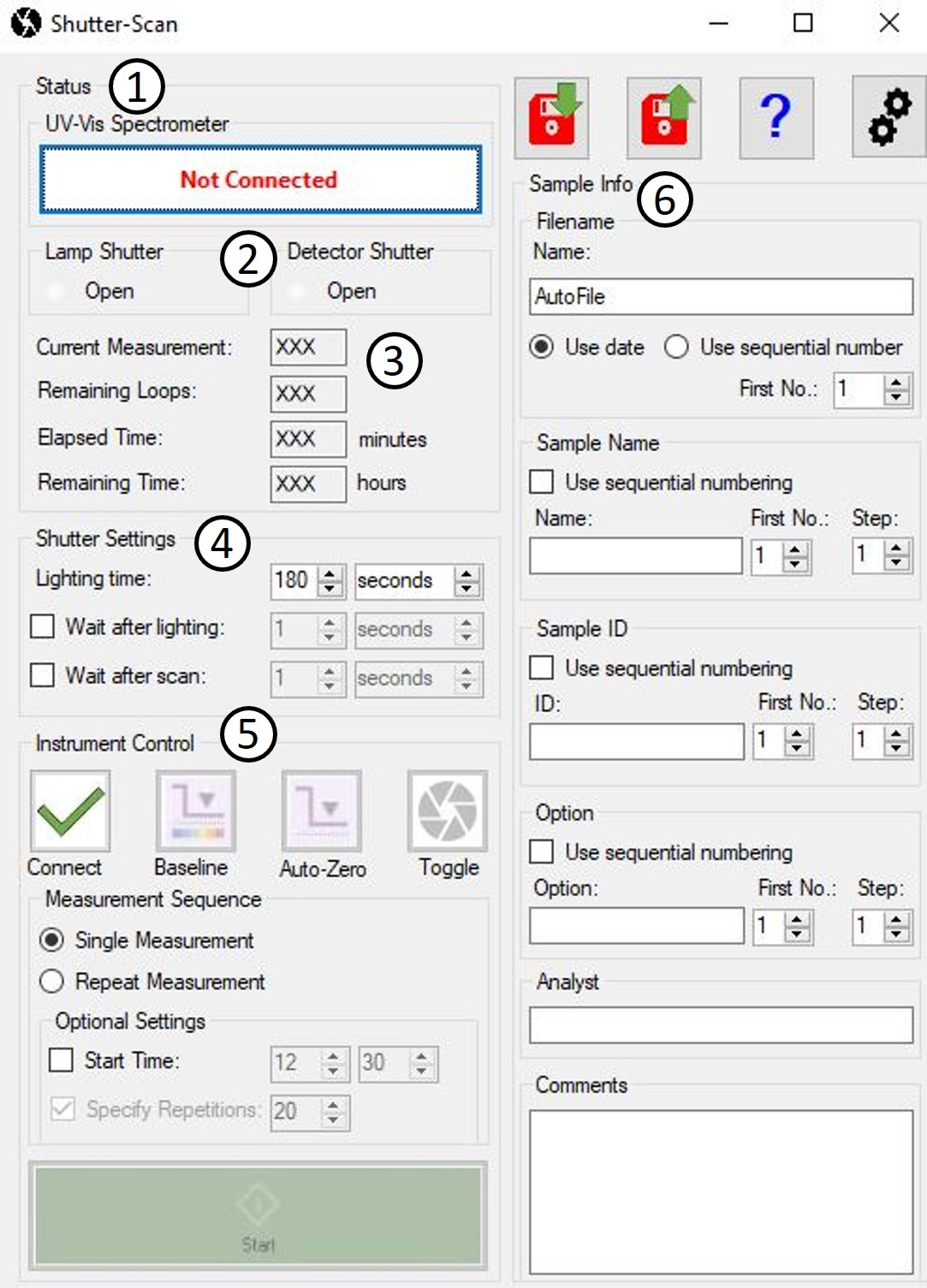
Die Steuerung der Shutter- und Mess-Software wird über ein LabSolutions UV-Vis Automatic-Control-Makro synchronisiert. Auf der grafischen Oberfläche (Abbildung 3) werden der Status des UV-Vis- Spektrometers (1) und Blenden (2) sowie der aktuelle Stand der laufenden Mess-Sequenz (3) dargestellt. Die Belichtungszeit (4) und optionale Wartezeit im Dunklen vor und nach jeder Messung kann in Sekunden, Minuten oder Stunden festgelegt werden. Über verschiedene Schaltflächen (5) können UV-Vis-Spektrometer und Shutter manuell angesteuert oder die automatische Mess-Sequenz gestartet werden. Die zur Zuordnung der Spektren benötigten Probeninformationen (6) werden vor Start der Mess-Sequenz eingegeben.
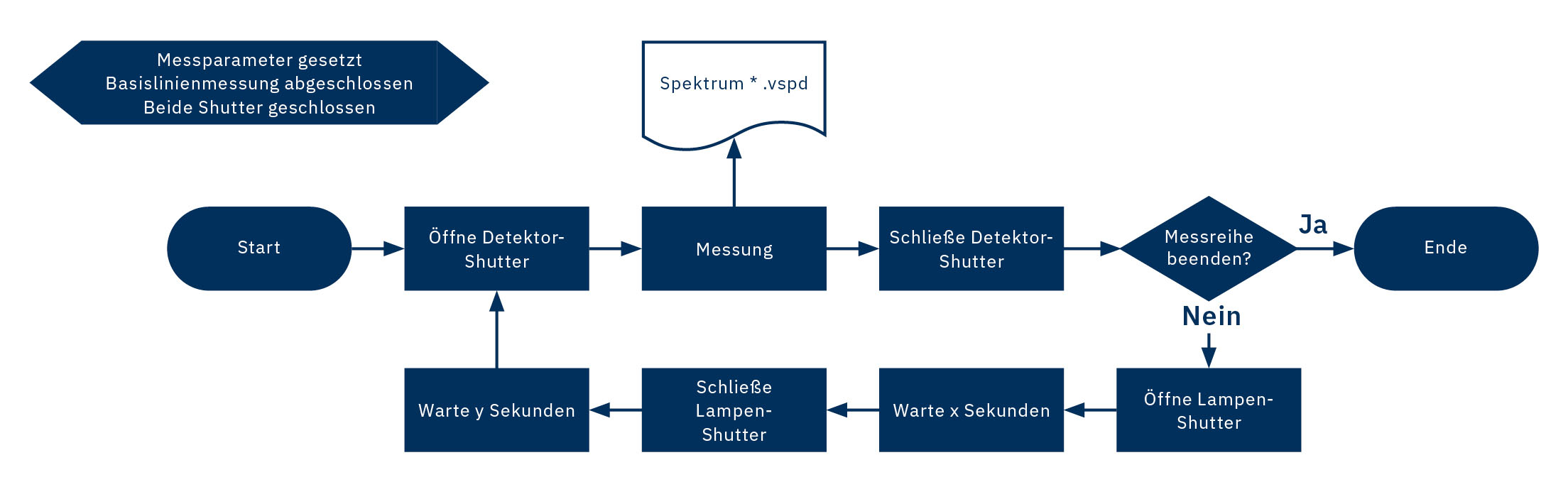
Der Ablauf des Experiments ist schematisch in Abbildung 4 dargestellt. Der Startpunkt beschreibt in diesem Diagramm nicht den Programmstart, sondern den Start der Mess-Sequenz nach der Basislinienmessung.
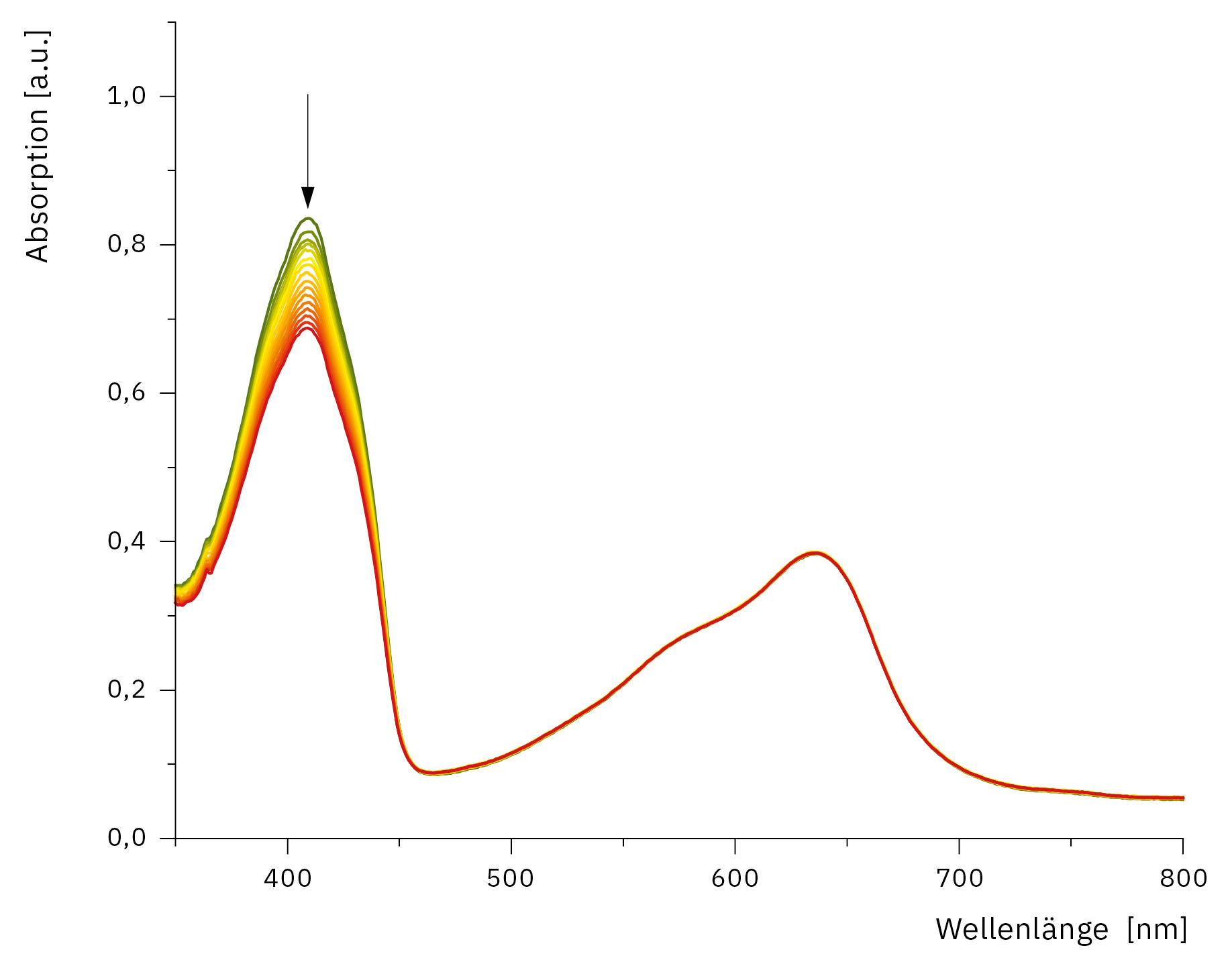
Mit dem Aufbau wird mittels UV-Vis-Spektroskopie die Produktion von ROS durch den Zerfall der Probensubstanz gemessen (Abbildung 5). Hier können verschiedene Probensubstanzen eingesetzt werden, in diesem Fall 1,3-Diphenylisobenzofuran (DPBF).
Weiterhin kann durch die Aufnahme von ganzen Spektren die Photostabilität des Photosensibilisators dargestellt werden. Der Aufbau ist in der Lage, aufgrund des sehr kleinen Zeitbedarfes des UV 1900i zeitlich hochaufgelöste Messungen in Intervallen von einer Minute durchzuführen. Durch diese sehr hohe Scanrate ist es möglich, durch die Messung ganzer Spektren die Stabilität der Substanzen zu beobachten. Dies ermöglicht auch, bisher nicht zugängliche, schnelle Reaktionskinetiken umfassend zu betrachten. Die Gesamtbeleuchtungszeit beträgt in der Regel bis zu 60 Minuten mit Beleuchtungsintervallen von 2 bis 5 Minuten. Abbildung 6 zeigt den Verlauf der Zersetzung von 1,3-Diphenylisobenzofuran durch von einem Holmiumkomplex erzeugte reaktive Sauerstoffspezies über 45 Minuten mit einem Beleuchtungsintervall von 3 Minuten.
Die Zersetzung der Probe ist deutlich an der abnehmenden Intensität des Absorptionspeaks bei 410 nm erkennbar, während die Absorption der Lösung im Bereich von 500 bis 700 nm zeitlich konstant bleibt.
Gezielte Vorauswahl dank schneller Analyse
Der automatisierte Messablauf und die kurze Messzeit des UV-1900i erlauben eine schnelle Analyse von Photosensibilisatoren. Damit wird eine qualifizierte Vorauswahl von geeigneten Molekülen ermöglicht, die für aufwendigere Studien erfolgversprechend sind.
Weiterführende Literatur
[1] Obitz, D.; Gkika, K. S.; Heller, M.; Keyes, T. E.; Metzler-Nolte, N. A Phototoxic Thulium Complex Exhibiting Intracellular ROS Production upon 630 nm Excitation in Cancer Cells. Chem. Commun. 2023, 59 (14), 1943–1946. https://doi.org/10.1039/D2CC06209G.