Die Kraft des Lichts nutzbar machen
Die bedeutende Rolle der Kleinoptik bei der Erforschung unserer Welt
Tomofumi Seto, Shimadzu Europa GmbH
Das Universum, ein riesiger Raum voller wunderbarer Himmelskörper, beflügelt die Fantasie der Menschheit schon seit Jahrhunderten. Doch wie lassen sich die Geheimnisse dieses kosmischen Gefüges enträtseln? Eine Antwort darauf ist das Licht. Durch die Analyse des Lichts, das von Himmelsobjekten ausgestrahlt oder absorbiert wird, können Wissenschaftler eine Menge über deren Zusammensetzung, Temperatur, Bewegung und sogar ihre Vergangenheit herausfinden. Mithilfe der Spektroskopie lässt sich das Universum auf bisher ungeahnte Weise erforschen. Dieser Artikel wirft einen Blick auf die spektroskopischen Elemente, die Beugungsgitter von Shimadzu und ihre Schlüsselrolle bei der Erforschung unserer Welt.
Die Ursprünge der Spektroskopie
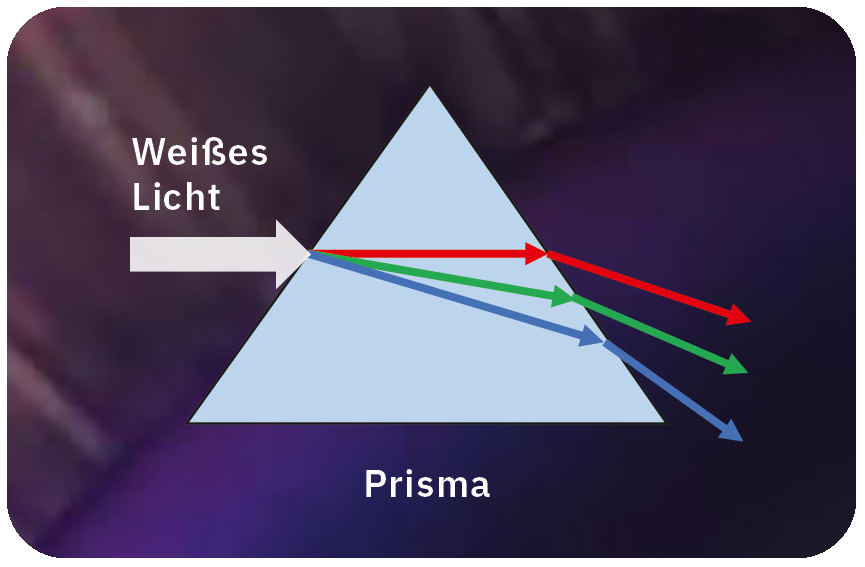
Im 17. Jahrhundert entdeckte der britische Physiker Isaac Newton, der große Forschungserfolge auf verschiedenen Gebieten erzielte, das Geheimnis des Lichts. Unter Verwendung von geschliffenen transparenten Objekten, sogenannten Prismen, beobachtete er, wie sich weißes Licht in ein Band verschiedener Farben wie ein Regenbogen aufspaltete. Seine Experimente zeigten, dass weißes Licht aus verschiedenen Farben oder Wellenlängen zusammengesetzt ist. Das bedeutet, dass Sonnenlicht oder fluoreszierendes Licht, das wir gewöhnlich sehen, alle Wellenlängen des Lichts enthält, also Rot, Grün, Blau und viele mehr.
Das von Newton entdeckte Band aus verschiedenen Wellenlängen wird als Spektrum bezeichnet. Durch die Analyse der Wechselwirkung eines Materials mit dem Spektrum lassen sich wertvolle Informationen über seine Eigenschaften gewinnen. Dieses Prinzip ist die Grundlage der modernen Spektroskopie.


Wichtiges Hilfsmittel für die Spektroskopie
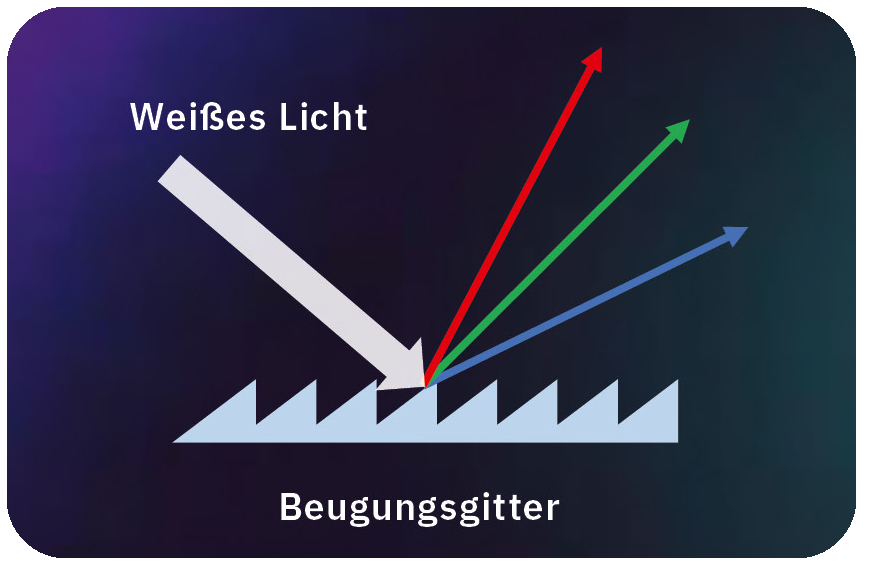
Bei der Spektroskopie wird zunächst ein optisches Element verwendet, um das Licht in verschiedene Wellenlängen aufzuteilen. Grundsätzlich gibt es zwei typische spektroskopische Elemente: Prismen und Beugungsgitter (Abbildung 2).
Prismen beruhen auf dem Prinzip der Brechung. Typischerweise handelt es sich dabei um dreieckige Körper aus Quarz oder Glas, die den Winkel des Lichts in Abhängigkeit von seiner Wellenlänge aufgrund der unterschiedlichen Ausbreitungsgeschwindigkeit in verschiedenen Medien krümmen. Diese Eigenschaft wird als Brechungsindex bezeichnet.
Bei Beugungsgittern findet ein anderes Prinzip Anwendung, nämlich die Beugung nach dem Huygensschen Prinzip, bei dem das Licht an den Ecken eines Hindernisses abgelenkt wird. Daher haben Beugungsgitter unzählige sehr kleine Rillen (Hindernisse) auf einer Substratoberfläche. Auch hier hängt der Beugungswinkel von der Wellenlänge ab, und so können verschiedene Farben voneinander getrennt werden. Dieser Effekt sorgt dafür, dass die Rückseite einer CD oder DVD bei Betrachtung aus bestimmten Winkeln viele verschiedene Farben reflektiert.
Heutzutage gelten Beugungsgitter aufgrund ihrer optischen Vorteile als Standard für spektroskopische Anwendungen. Die Genauigkeit der Wellenlängenauflösung ist hoch und im Vergleich zu Prismen stabiler bei Temperaturänderungen. Aus diesem Grund eignen sich Beugungsgitter oft besser für die Spektroskopie.
Geschichte des Beugungsgitters
Bis Mitte des 20. Jahrhunderts wurden in der Spektroskopie hauptsächlich Prismen verwendet. Zwar gab es auch Beugungsgitter, jedoch waren sie nicht weit verbreitet, da sie schwierig herzustellen waren. Ihre Rillen müssen präzise und gleichmäßig auf der Oberfläche verlaufen. Die Herstellungstechnologie war jedoch damals noch nicht ausgereift und daher war ihre Leistung der von Prismen noch unterlegen. Außerdem waren die Produktionszahlen von Gittern begrenzt und ihre Verfügbarkeit war in Bezug auf Preis und Lieferzeit ungünstig.
Mit zunehmender Forschung wurde die Technologie zur Herstellung von Beugungsgittern jedoch immer besser und entwickelte sich zu einer leistungsstarken und großtechnischen Produktionstechnologie, die zum Ersatz von Prismen in spektroskopischen Instrumenten führte.
Die Rolle von Shimadzu bei der Herstellungstechnologie von Beugungsgittern
Es gibt zwei Arten von Beugungsgittern. Das eine ist ein Liniengitter, bei dem die Rillen maschinell eingraviert werden. Das andere ist ein holografisches Gitter, das durch ein holografisches Belichtungsverfahren unter Verwendung der Zwei-Quellen-Interferenz eines Lasers erzeugt wird.
Beim holografischen Gitter entsteht nur wenig Streulicht, was allgemein unerwünschtes Licht oder Wellenlängen bezeichnet, die unerwartet erzeugt werden. Besonders im Bereich der spektroskopischen Analyse hat Streulicht einen negativen Einfluss auf die Analysegenauigkeit. Die Rillen eines holografischen Gitters sind präziser geformt als die eines Liniengitters, sodass weniger Streulicht entsteht.
Andererseits haben holografische Gitter den Nachteil, dass die Intensität des gebeugten Lichts geringer ist. Eine Möglichkeit, dies zu umgehen, ist die Verwendung von sägeförmigen „Blaze-Rillen“, die die Lichtintensität der gewünschten Wellenlängen erhöhen. Früher konnten diese Rillenformen jedoch nur durch das Linienverfahren hergestellt werden, da man es für unmöglich hielt, Blaze-Rillen mit der holografischen Methode herzustellen.
Shimadzu bemühte sich jedoch um die Entwicklung eines holografischen Blaze-Gitters mit geringem Streulicht und der gleichen Beugungslichtintensität wie der von Liniengittern. Nach vielen Jahren der Forschung in Zusammenarbeit mit dem RIKEN, einem japanischen Institut für physikalische und chemische Forschung, gelang es, Blaze-Rillen für holografische Gitter zu erzeugen und die weltweit erste Fertigungstechnologie für Blaze-Hologramme zu entwickeln.

Aktueller Entwicklungsstand der Beugungsgitter
Die Beugungsgitter von Shimadzu werden heute dank ihrer Herstellungstechnologie und der umfangreichen Palette an maßgeschneiderten und anwendungsspezifischen Lösungen in vielen Bereichen eingesetzt.
In der Analyse und Inspektion dienen sie als wichtige Bestandteile der Ausrüstung für interne Produkte und externe Kunden. Darüber hinaus werden sie zunehmend in Bereichen wie der Lebensmittelindustrie, der Halbleiterherstellung und bei Blutuntersuchungen eingesetzt.
Die Beugungsgitter werden nicht nur zu Analysezwecken verwendet, sondern auch zur Unterstützung der optischen Kommunikation als Teil von wellenlängenselektiven Schaltern (WSS). WSS steuern die Wellenlänge von optischen Signalen, um eine effiziente Übertragung von Informationen bei der optischen Kommunikation zu ermöglichen.
Der Einsatz von Beugungsgittern beschränkt sich nicht nur auf die Erde, sondern reicht bis in den Weltraum. Der spektroskopische Satellit „Hisaki“ (SPRINT-A) wurde 2013 erfolgreich in Japan in die Umlaufbahn gebracht. Das Beugungsgitter von Shimadzu bildet das Herzstück des Satelliten. Hisaki ist das weltweit erste Weltraumteleskop zur Fernbeobachtung von Planeten wie Venus, Mars und Jupiter. Er analysiert die Atmosphäre der Planeten durch die Beobachtung von extrem ultraviolettem Licht, das auf der Erde nicht nachgewiesen werden kann, und trägt zur Aufklärung der Mysterien des Weltraums bei.
Für die Bedürfnisse jedes Kunden geeignet
Beugungsgitter unterstützen spektroskopische Technologien in den verschiedensten Industriebereichen und Forschungsinstituten. Sie haben über viele Jahre hinweg dazu beigetragen, technologisches Fachwissen aufzubauen. Heutzutage bietet Shimadzu eine Vielfalt von Beugungsgittern für alle Kundenbedürfnisse und -anwendungen an, mit den Vorteilen eines geringen Streulichts und einer hohen Beugungseffizienz. Die unablässige Herausforderung, die vielfältigen Anforderungen der Spektroskopie zu erfüllen, wird weitergehen, genau wie die Entdeckung des Universums.
[1] T. Namioka, J. Spectroscopic. Soc. Japan Vol.34 No.1, 41-53, 1984
[2] M. Seya, J. Spectroscopic. Soc. Japan Vol.19 No.1, 43-51, 1970
[3] K. Sano, Y. Aoyagi, and S. Namba, OYO BUTURI, Vol.48, 539-544, 1979
[4] K. Sano, Y. Aoyagi, and S. Namba, Opt. Commun., Vol.29, 253-255, 1979