Lebensmittel und Getränke im Fokus
Verbesserung der Aminosäureanalyse mittels automatischer Vorsäulenderivatisierungsmethode
Natsuki Iwata, Shimadzu Corporation
Vadim Kraft, Shimadzu Europa GmbH


Die Prüfung von Lebensmitteln und Getränken auf Sicherheit, Echtheit, Qualität und Nährstoffgehalt ist für die öffentliche Gesundheit, das Verbrauchervertrauen und den Geschäftserfolg von entscheidender Bedeutung. In einem kürzlich durchgeführten Machbarkeitsnachweis mit alkoholischen Getränken wurde eine optimierte neue Methode zur Bewertung von Aminosäuren bestätigt, die auch für andere Lebensmittel und Getränke angewendet werden kann. Die Methode bietet eine höhere Genauigkeit und reduziert gleichzeitig die Testlaufzeiten um bis zu 50 %.
Wir alle erinnern uns an die Schlagzeilen: Rinderhack, das Pferdefleisch enthielt, Fruchtsäfte, die keine waren, teure Markenwhiskys, die sich als Fälschungen entpuppten, und gepanschter Honig. Oder an den Skandal von 2009, als Milch und Säuglingsnahrung mit Melamin versetzt wurden, um sie proteinreicher wirken zu lassen – was tragischerweise zu Erkrankungen und Todesfällen führte.
Die Sicherheit und Qualität der Lebensmittel und Getränke, die wir zu uns nehmen, ist ein so fundamentaler Bestandteil des modernen Lebens, dass wir sie oft als selbstverständlich ansehen. Wir gehen davon aus, dass die Angaben auf dem Etikett zu den Zutaten oder Nährwerten die tatsächlichen Inhaltsstoffe genau widerspiegeln. In den meisten Fällen ist dies auch so. Gesetze, Vorschriften, ethische Praktiken und Experten verschiedener Fachrichtungen sorgen gemeinsam dafür, dass Verbraucher wissen, was sie erhalten, und dass die Produkte unbedenklich konsumiert werden können. Da Wissenschaft und Technologie sich ständig weiterentwickeln, werden auch die Vorschriften immer wieder angepasst, wobei verantwortungsbewusste Unternehmen diesen immer höheren Standards folgen.
Durch die Prüfung von Lebensmitteln und Getränken wird sichergestellt, dass die gesetzlichen Standards eingehalten werden. Die Aminosäureanalyse ist eines der ausgefeilteren Verfahren, mit denen Wissenschaftler die Qualität, Sicherheit und Echtheit unserer Lebensmittel und Getränke kontrollieren und die Mengen verschiedener Inhaltsstoffe – beispielsweise Proteine – für eine zuverlässige Nährwertkennzeichnung bestimmen. Die Aminosäureanalyse liefert eine zuverlässige Identifizierung, eine Art hochentwickelten Fingerabdruck, der Aufschluss darüber gibt, ob ein Lebensmittelprodukt tatsächlich die angegebenen Inhaltsstoffe enthält. Minderwertige, gefährliche oder einfach falsche Inhaltsstoffe oder sogar die unsachgemäße Mischung der richtigen Inhaltsstoffe lassen sich durch Aminosäuretests genau identifizieren, wodurch die Gesundheit, der Geschäftserfolg und die Verbraucherzufriedenheit gefördert werden.
Natsuki Iwata gilt im japanischen Kyoto als Expertin auf dem Gebiet der Aminosäuretests mittels Hochleistungsflüssigkeitschromatographie (HPLC) und kann zahlreiche Patente, Auszeichnungen und Veröffentlichungen vorweisen. Kürzlich führte sie ein Experiment durch, bei dem sie Aminosäureprofile von alkoholischen Getränken erstellte.
Aminosäuren und ihre Verwendung
Aminosäuren kommen in zwei spiegelbildlichen Formen vor, die als D- und L-Enantiomere bezeichnet werden. Obwohl L-Aminosäuren in biologischen Systemen am häufigsten vorkommen, haben D-Aminosäuren in letzter Zeit aufgrund ihrer Auswirkungen auf den Geschmack und die Haltbarkeit von Lebensmitteln sowie ihrer neuen Rolle als Biomarker für Krankheiten an Bedeutung gewonnen.[1] D-Aminosäuren weisen im Vergleich zu den L-Varianten charakteristische Geschmackseigenschaften auf. So verleihen beispielsweise D-Leucin und D-Phenylalanin einen süßen Geschmack, wohingegen die entsprechenden L-Aminosäuren als bitter empfunden werden. Das spezifische Gleichgewicht von D- und L-Aminosäuren in Lebensmitteln trägt zur Gesamtkomplexität des Geschmacks bei.
Einst galten D-Aminosäuren als biologisch inaktiv, doch mittlerweile hat sich gezeigt, dass sie beim Menschen und in anderen Organismen spezifische physiologische Funktionen erfüllen, beispielsweise die Darmgesundheit unterstützen und den Stoffwechsel beeinflussen. Die Forschung auf diesem Gebiet ist jedoch noch nicht abgeschlossen. Das Verhältnis von D- zu L-Aminosäuren in Lebensmitteln ist zudem nützlich für die Beurteilung von Verarbeitungstechniken und der Authentizität von Produkten, insbesondere bei fermentierten oder gereiften Lebensmitteln.
Die genaue Trennung und Messung von D- und L-Aminosäuren ist daher in der Lebensmittelwissenschaft und in klinischen Anwendungen von zunehmender Bedeutung. Herkömmliche Analysemethoden wie Flüssigchromatographie-Massenspektrometrie (LC-MS) und mehrdimensionale HPLC haben jedoch ihre Grenzen. Die LC-MS kann beispielsweise durch die Komplexität der Probenmatrix beeinträchtigt werden, während multidimensionale Systeme zeitaufwendig und kompliziert in der Handhabung sein können. Daher besteht offensichtlich ein Bedarf an schnellen, unkomplizierten und zuverlässigen Analysetechniken für die Quantifizierung von D-/L-Aminosäuren.
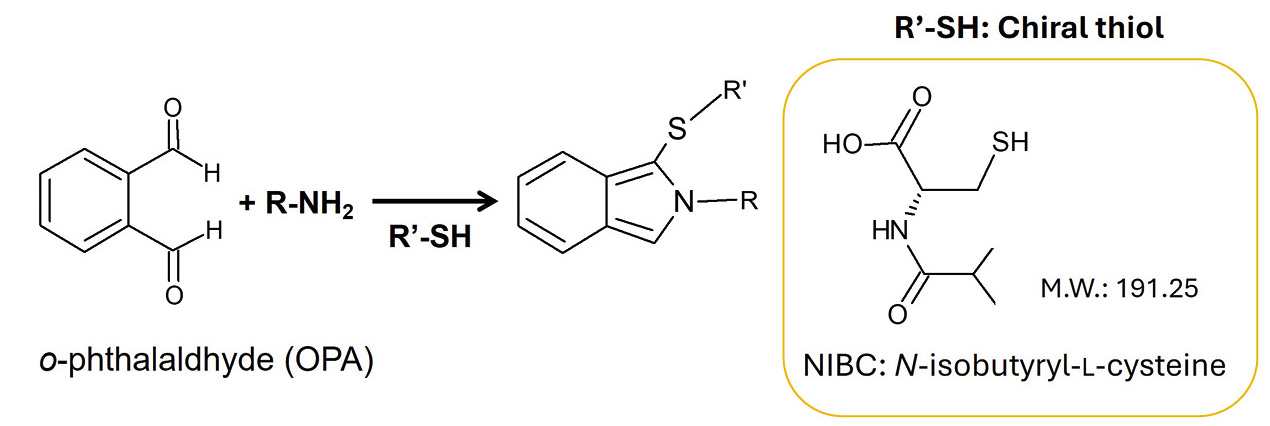
Im Rahmen einer Studie von Natsuki Iwata wurde die Methode einer Derivatisierungsreaktion von o-Phthalsäurealdehyd (OPA) mit dem chiralen Thiol N-Isobutyryl-L-Cystein (NIBC) untersucht, gefolgt von einer Analyse mittels Flüssigchromatographie. Die ersten Veröffentlichungen zu diesem Thema stammen von Euerby et al. aus den späten 1980er-Jahren. [2–7] In diesen Studien wurden verschiedene chirale Thiole synthetisiert und nach manueller Derivatisierung mit OPA in einer Umkehrphasen-HPLC untersucht, wodurch die Trennung von D- und L-Enantiomeren mehrerer Aminosäuren ermöglicht wurde.
Führt bessere Technologie zu besseren Methoden?
Natsuki Iwata war sich der bedeutenden Entwicklungen in der Flüssigchromatographie in den letzten Jahren bewusst und kam zu dem Schluss, dass modernste UHPLC-Geräte (Ultra-HPLC) eine vollautomatische Derivatisierung und hocheffiziente Trennung von Verbindungen ermöglichen sollten. Genau das wollte sie untersuchen.
Als Proben dienten zwei Biersorten (Bier A und B), Sake, Rotwein und Weißwein. Bier A und Bier B waren jeweils vom Typ Ale („obergärig“) und Lager („untergärig“). Bier A, Bier B, Rotwein und Weißwein wurden mit 10 mmol/l Salzsäure zehnfach (Sake zwanzigfach) verdünnt und anschließend durch 0,2-μm-PTFE-Membranfilter geleitet.

| 1 |
OPA-Reagenz 0,3 ml Ethanol zu 10 mg o-Phthalsäurealdehyd hinzugeben und vollständig auflösen. Anschließend 0,7 ml 0,1 mol/l Boratpuffer (pH 9,1) und 4 ml ultrareines Wasser hinzugeben. |
| 2 |
NIBC-Lösung 10 mg N-Isobutyryl-L-Cystein in 10 ml 0,1 mol/l Boratpuffer (pH 9,1) |
| 3 |
OPA-/NIBC-Lösung Gleiche Menge OPA-Reagenz und NIBC-Lösung mischen. |
Sorgfältige Vorbereitung ist entscheidend
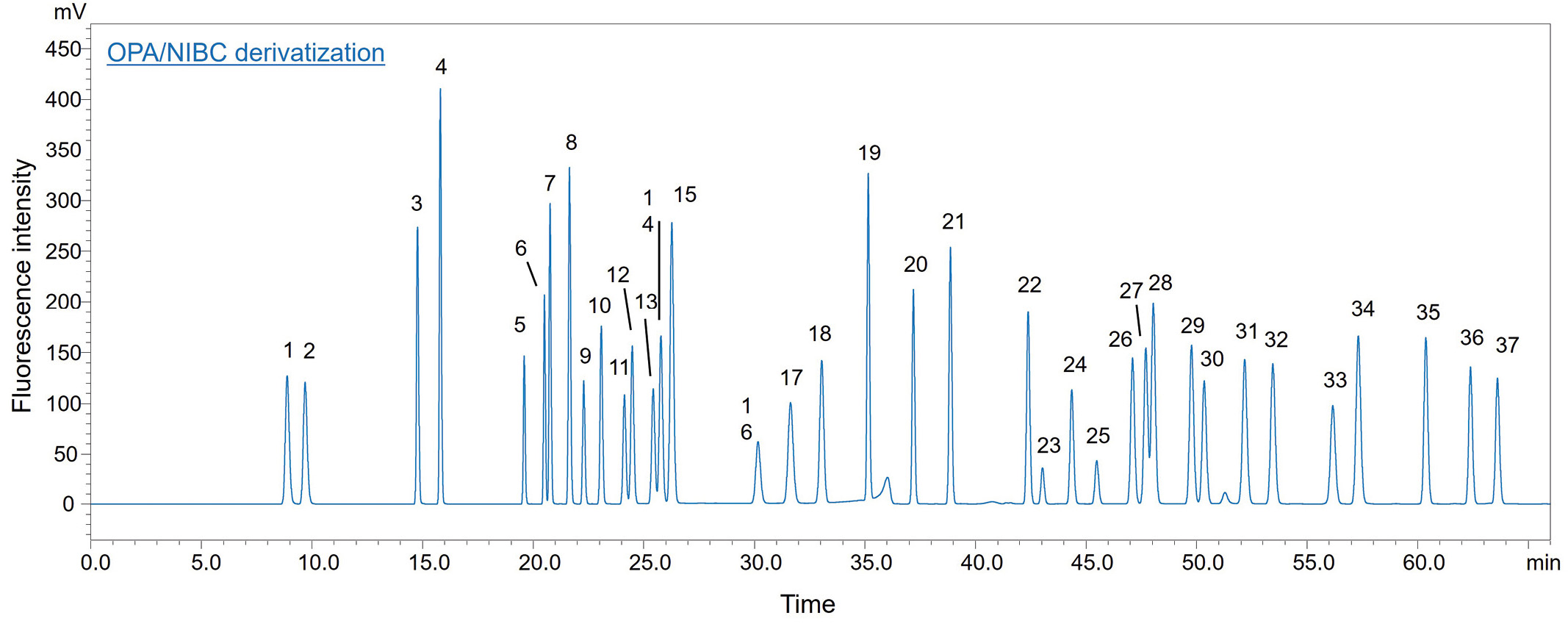
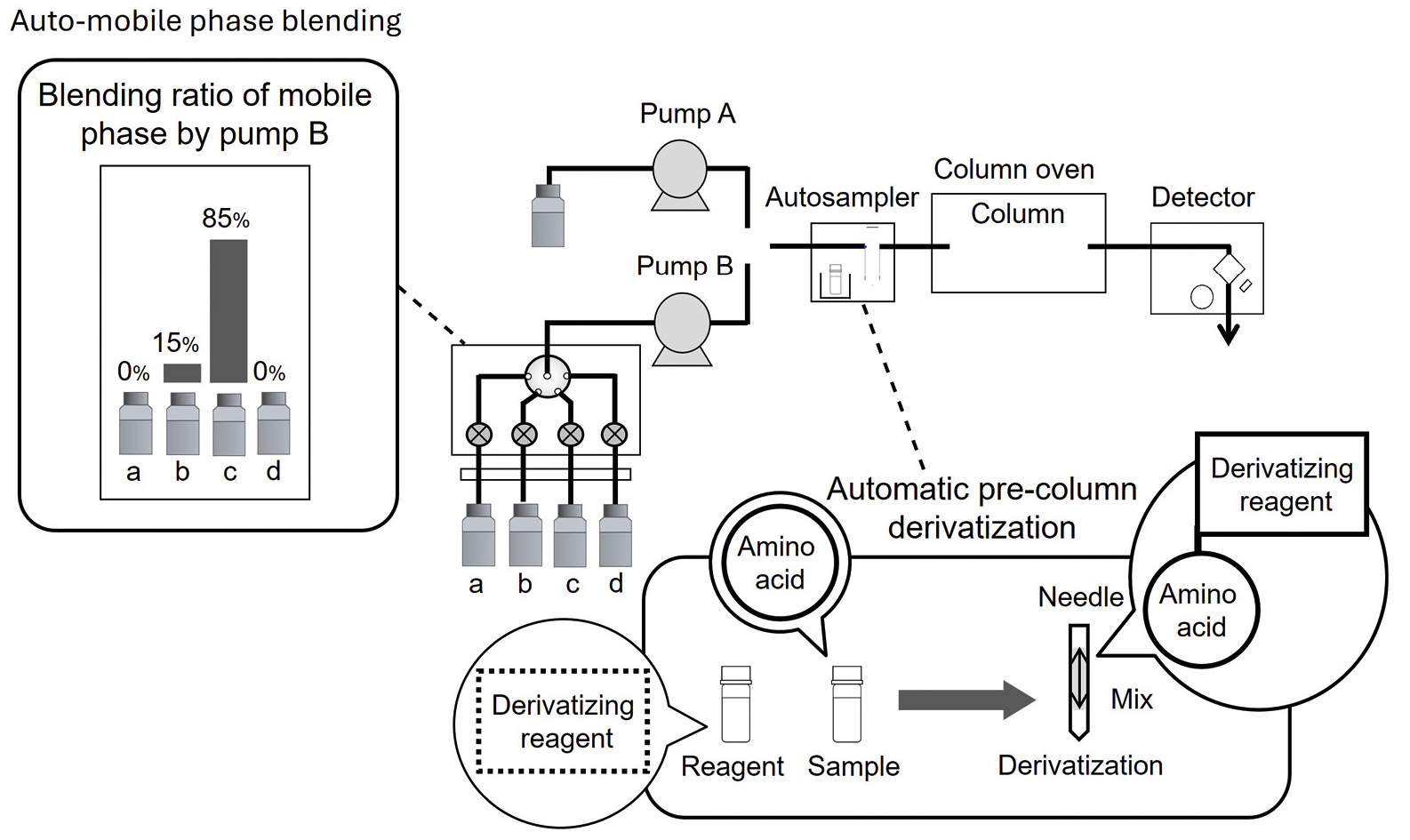
Die Fluoreszenzderivatisierung der Diastereomere erfolgte durch Reaktion mit OPA unter NIBC-Bedingungen. Zur Bestimmung von 37 D-/L-Aminosäuren wurde ein handelsübliches UHPLC-Gerät (Shimadzu) mit Fluoreszenzdetektor verwendet (Abbildung 2). Die Hauptkomponentenanalyse (PCA) wurde mit eMSTAT – der Easy Mass Spectrometric Statistical Solution von Shimadzu – durchgeführt. Die analytischen Bedingungen sind in Tabelle 2 dargestellt. Tabelle 1 und 3 enthalten detaillierte Angaben zur Vorbereitung der Reagenzien und zum Derivatisierungsverfahren des Autosamplers.
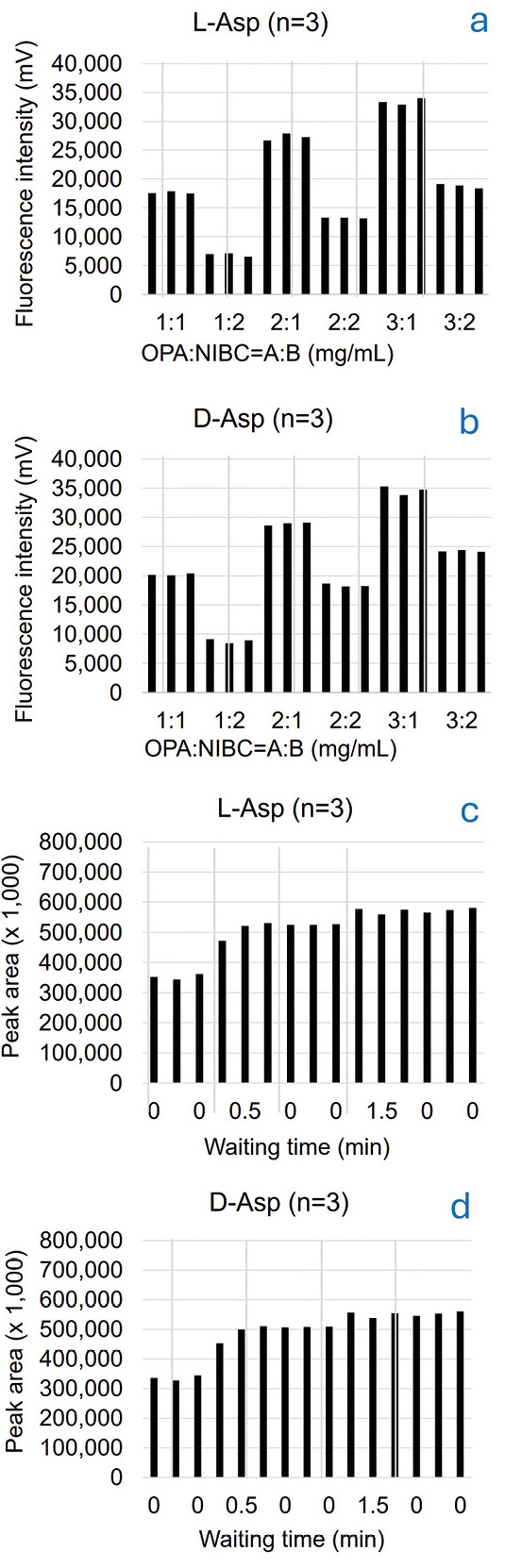
Die optimale Kombination aus der Konzentration des OPA-Reagenzes und der NIBC-Lösung wurde unter Verwendung einer Standardlösung aus D-/L-Aminosäuren (jeweils 1 μmol/l) untersucht. Es wurden sechs Kombinationen mit unterschiedlichen Konzentrationen analysiert. Die Fluoreszenzintensitäten von D-/L-Asp stiegen mit zunehmender OPA-Konzentration bei konstanter NIBC-Konzentration an. Demgegenüber nahmen die Fluoreszenzintensitäten von D-/L-Asp mit zunehmender NIBC-Konzentration bei konstanter OPA-Konzentration ab. Die Kombination von 3 mg/ml OPA und 1 mg/ml NIBC bewirkte einen Anstieg des Säulenrückdrucks, möglicherweise aufgrund von Blockierungen. Daher wurde die Kombination von 2 mg/ml für OPA und 1 mg/ml für NIBC als optimale Konzentration bestimmt (Abbildung 3a und 3b).
Um die Derivatisierungsreaktion zu begünstigen und eine gute Wiederholgenauigkeit zu erzielen, wurde eine feste Wartezeit nach dem Mischen der OPA-/NIBC-Lösung und der Probe in der Injektionsnadel des Autosamplers in das Vorbehandlungsprogramm aufgenommen. Im Vorfeld wurden fünf verschiedene Wartezeiten geprüft. Da die Peakfläche nach 1,5 Minuten und mehr konstant war, wurde die Wartezeit auf 1,5 Minuten festgelegt (Abbildung 3c und 3d).
Bewährungsprobe für die Methode: Analyse einer Standardlösung von 37 D-/L-Aminosäuren
Bei einer zuvor beschriebenen Methode mit zwei Wechselbedingungen betrug die Analysezeit pro Probe 120 Minuten.[8] Dabei wurden zwei chirale Thiole, N-Acetyl-L-Cystein (NAC) und NIBC, unabhängig voneinander für die Reaktionen verwendet. Ihre Produkte mit Aminosäuren wurden getrennt und die Ergebnisse beider Chromatogramme kombiniert, wobei die Gesamtanalysezeit jeweils 60 Minuten betrug.
Natsuki Iwata entschied sich jedoch, für die Reaktion ausschließlich NIBC zu verwenden. Durch Erhöhung des Methanolanteils in der mobilen Phase, Einstellung der Säulentemperatur auf 20 °C und Trennung auf einer einzigen Säule konnten alle 37 Diastereomere der D- und L-Aminosäuren in einer einzigen Analyse innerhalb von nur 66 Minuten getrennt werden (Abbildung 4), wodurch sich die Gesamtanalysezeit fast um die Hälfte verkürzte. Eine Übersicht über die getrennten Aminosäuren ist in Tabelle 4 dargestellt. Tabelle 5 enthält eine Beschreibung der Abkürzungen für Aminosäuren.
| System | NexeraTM X3 |
| Säule |
CERI L-column3 C18 (150 mm x 2,1 mm I.D., 2,0 µm) mit Vorsäulenfilter |
| Durchflussrate | 0,22 mL/min |
| Mobile Phase |
[Pumpe A] 10 mmol/l
(Natrium-)Phosphatpuffer (pH 6,9) [[Pumpe B] B) Acetonitril, C) Methanol B/C = 15:85 unter Verwendung der Mischfunktion für mobile Phasen |
| Zeitprogramm | Gradientenelution |
| Säulentemperatur | 20 °C |
| Injektionsvolumen | 1 µL |
| Nachweis | FL Ex: 338 nm, Em: 455 nm |
| 1 | OPA-/NIBC-Lösung 2 ul |
| 2 | Probe 1 ul |
| 3 | Mischen |
| 4 | 1,5 Minuten warten |
| 5 | Injektion |
| 1 | L-Asp | 20 | L-Tyr |
| 2 | D-Asp | 21 | D-Tyr |
| 3 | L-Glu | 22 | L-Val |
| 4 | D-Glu | 23 | L-(Cys)2 |
| 5 | L-Asn | 24 | L-Met |
| 6 | D-Asn | 25 | D-(Cys)2 |
| 7 | L-Ser | 26 | L-Trp |
| 8 | D-Ser | 27 | D-Met |
| 9 | L-Gln | 28 | D-Val |
| 10 | D-Gln | 29 | L-Ile |
| 11 | L-His | 30 | L-Phe |
| 12 | L-Thr | 31 | D-Trp |
| 13 | D-His | 32 | D-Phe |
| 14 | D-Thr | 33 | L-Leu |
| 15 | Gly | 34 | D-Ile |
| 16 | L-Arg | 35 | D-Leu |
| 17 | D-Arg | 36 | L-Lys |
| 18 | L-Ala | 37 | D-Lys |
| 19 | D-Ala |
| Asp | Asparaginsäure |
| Glu | Glutaminsäure |
| Asn | Asparagin |
| Ser | Serin |
| Gln | Glutamin |
| His | Histidin |
| Thr | Threonin |
| Gly | Glycin |
| Arg | Arginin |
| Ala | Alanin |
| Tyr | Tyrosin |
| Val | Valin |
| (Cys)2 | Cystin |
| Met | Methionin |
| Trp | Tryptophan |
| Ile | Isoleucin |
| Phe | Phenylalanin |
| Leu | Leucin |
| Lys | Lysin |
Validierung der Methode
Die relativen Standardabweichungen (%RSD, n = 6) der Peakflächen für eine Standardmischung aus D-/L-Aminosäuren (jeweils 0,1 μmol/l) betrugen maximal 1,6 %, was auf eine hervorragende Wiederholgenauigkeit hinweist. Diese starke Beständigkeit wurde durch die automatische Vor-säulenderivatisierung erreicht, wodurch eine konstante Derivatisierungszeit gewährleistet wurde. Die Kalibrierungskurven für alle 37 D-/L-Aminosäuren zeigten eine gute Linearität mit Bestimmungskoeffizienten (r²) von 0,999 oder höher. Für die Rückgewinnungsprüfung wurde Bier B ausgewählt und mit einer Standardlösung versetzt, die 31 D-/L-Aminosäuren enthielt. Die Endkonzentration wurde für die meisten Aminosäuren auf 1 μmol/l festgelegt. Sechs Aminosäuren wurden stattdessen auf eine Endkonzentration von jeweils 10 μmol/l eingestellt. Die sechs Proben wurden gleichzeitig gemäß dem festgelegten Protokoll vorbehandelt. Die Rückgewinnungsraten lagen zwischen 84,9 % und 108,6 % mit %RSD-Werten zwischen 0,8 % und 9,5 %, was die Zuverlässigkeit und Genauigkeit der Methode belegt.
Anwendung der Methode auf alkoholische Getränke
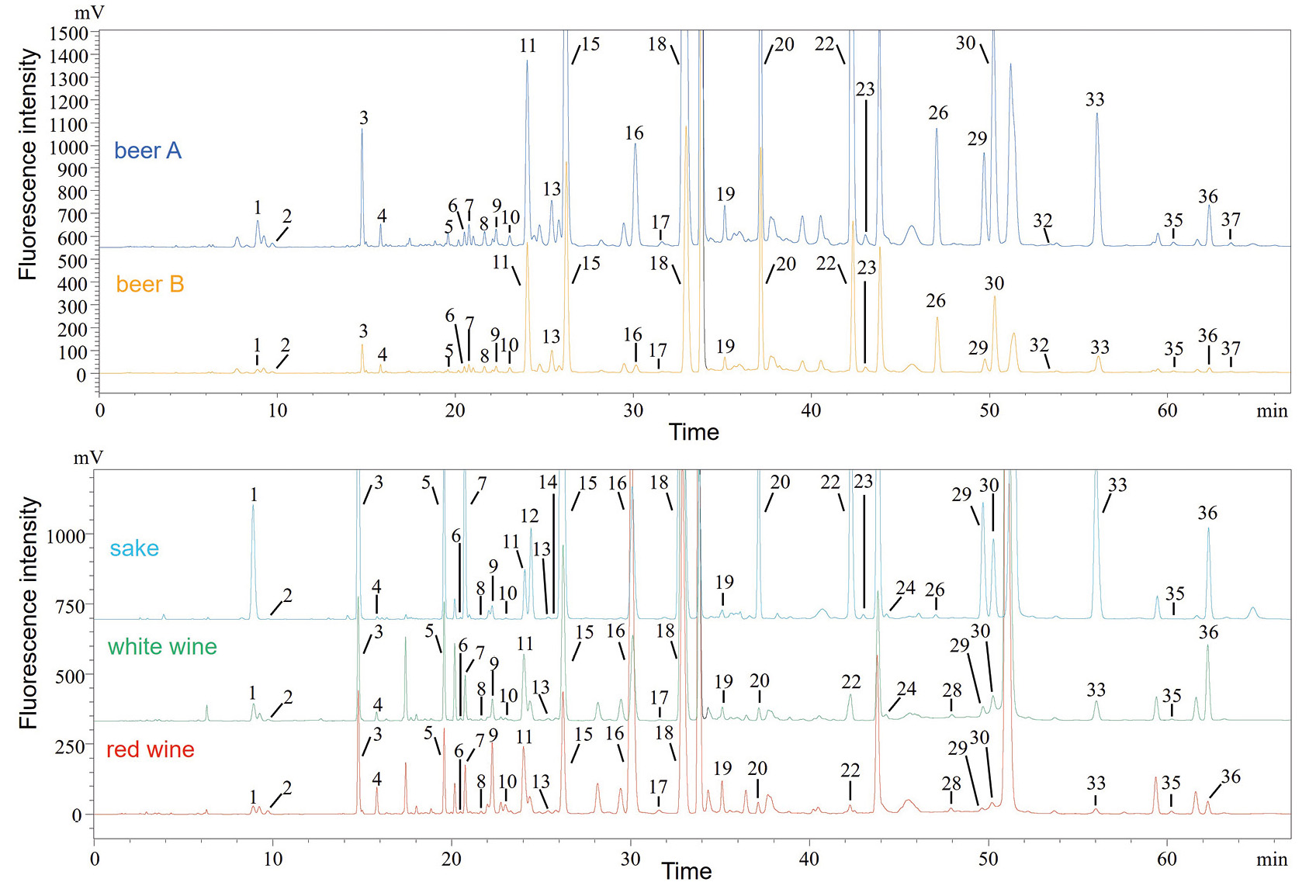
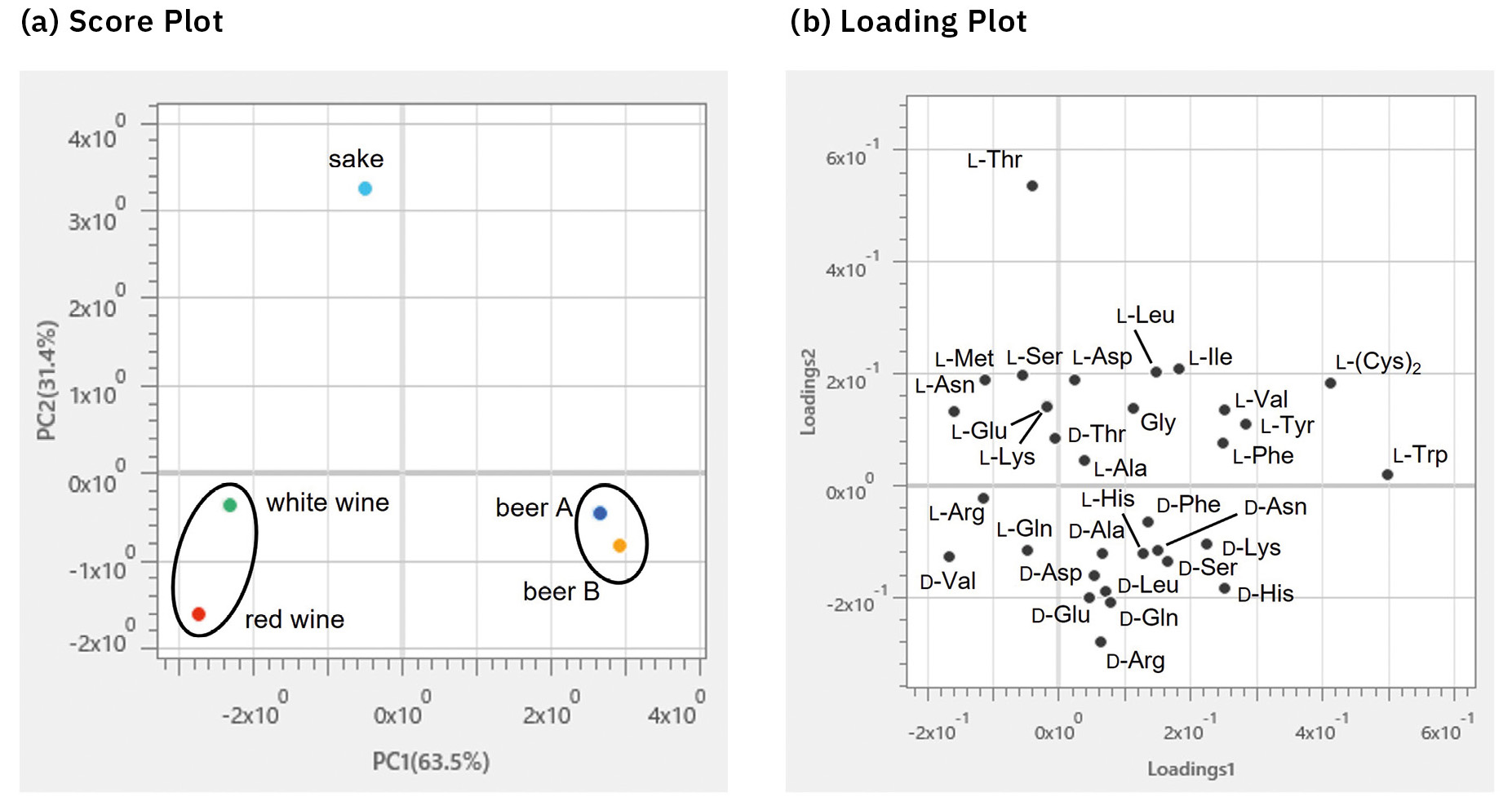
Wie in Abbildung 5 dargestellt, wurden in fünf Proben 25 bis 28 Aminosäuren getrennt und nachgewiesen. Das Gesamtverhältnis von D-Aminosäuren zu D-/L-Aminosäuren (%D) lag in allen Proben bei höchstens 6 %. Die Ergebnisse der Bestimmung der D-/L-Häufigkeitsverhältnisse spezifischer Aminosäuren lagen nahe an denen früherer Studien, in denen HPLC [9] und GC-MS [10] zur Analyse verschiedener realer Proben verwendet wurden. Einzelheiten zu den Quantifizierungsergebnissen sind in der Veröffentlichung enthalten. Es wurde eine PCA unter Verwendung des Gehalts jeder Verbindung (n = 4) in Getränken durchgeführt (Abbildung 6). Als Ergebnis der PCA wurden Bier A und Bier B sowie Rot- und Weißweine nahe beieinander im Diagramm dargestellt. Außerdem wurde festgestellt, dass Sake andere Eigenschaften als diese Getränke aufwies. Das Diagramm zeigte, dass die beiden Biersorten sowie die Rot- und Weißweine viele D-Isomere enthielten, während der Sake reich an L-Isomeren war. Insbesondere L-Trp, D-His und D-Lys trugen erheblich zu den beiden Biersorten bei, D-Val zu den Rot- und Weißweinen und L-Thr zum Sake. Dies deutete darauf hin, dass die erste Hauptkomponente (PC1) Unterschiede in den Getränketypen aufwies, während die zweite Hauptkomponente (PC2) Unterschiede in den Isomeren offenbarte.
Der Weg zu besseren Ergebnissen
Es wurde eine neue Methode zur gleichzeitigen Trennung von 37 OPA-/NIBC-derivatisierten D- und L-Aminosäuren unter Verwendung eines einfachen UHPLC-Systems entwickelt. Mit dieser Methode lassen sich durch eine einzige Analyse mit automatisierter Probenhandhabung und optimierten Daten in etwa der Hälfte der Zeit, die bei herkömmlichen Techniken erforderlich ist, Verarbeitungsergebnisse erzielen.
Darüber hinaus birgt dieses Verfahren ein großes Potenzial für die Anwendung bei der Profilierung alkoholischer Getränke und damit für einen breiten Einsatz in der gesamten Lebensmittel- und Getränkeindustrie.
Steigende Verbrauchererwartungen und strengere Vorschriften können nun durch eine hochpräzise, zuverlässige und effizientere Methode zur Analyse von Aminosäuren erfüllt werden, die die Verarbeitungszeit verkürzt und die Qualitätskontrolle sowie die Profilerstellung in der Lebensmittel- und Getränkeindustrie verbessert. Möglich ist dies dank technologischer Fortschritte und der unermüdlichen Tatkraft von Fachleuten wie Natsuki Iwata von Shimadzu.
[1] Iwata, N., Kobayashi, M. (2024). Chromatography. 45 (2): 63–72.
[2] Euerby, M.R., Partridge, L.Z., Gibbons, W.A. (1989). Journal of Chromatography A. 483: 239–252.
[3] Euerby, M.R., Partridge, L.Z., Rajani, P. (1988). Journal of Chromatography A. 447: 392–397.
[4] Euerby, M.R., Nunn, P.B., Partridge, L.Z. (1989). Journal of Chromatography A. 466: 407–414.
[5] Euerby, M.R., Partridge, L. Z., Nunn, P.B. (1989). Journal of Chromatography A. 469: 412–419.
[6] Euerby, M.R. (1988). Journal of Chromatography A. 454: 398–405.
[7] Euerby, M.R., Partridge, L.Z., Gibbons, W.A. (1988). Journal of Chromatography A. 445: 433–440.
[8] Iwata, N., Watabe, Y., Horie, S., Hayakawa, Y. (2021). Chromatography. 42: 133–141.
[9] Jin, D., Miyahara, T., Oe, T., Toyo’oka, T. (1999). Anal. Biochem. 269: 124–132.
[10] Ali, H.S., Pätzold, R., Brückner, H. (2010). Amino Acids. 38: 951–958.