Von Tausenden Puzzleteilen zu einem klaren Bild
Erfolgreiche Methodenentwicklung für die Analyse komplexer Proben
Dr. Martin Meyer, Shimadzu Europa GmbH

Die moderne Hochleistungsflüssigkeitschromatographie (HPLC) ist das Mittel der Wahl, um komplexe Proben zu analysieren. Ihre Anwendungsgebiete sind äußerst vielfältig: Sie wird eingesetzt um die Zusammensetzung von Lebensmitteln zu bestimmen, unerwünschte Begleitstoffe in Arzneimitteln aufzuspüren oder selbst geringste Schadstoffspuren im Trinkwasser zu detektieren. Für jede neue Fragestellung muss jedoch eine passgenaue Trennmethode entwickelt werden – eine Aufgabe, die einem vielteiligen Puzzle gleicht. Anfangs scheinen die Möglichkeiten schier grenzenlos, doch systematisches Vorgehen führt Schritt für Schritt zum vollständigen Bild.
Strukturiert schneller zum Ziel
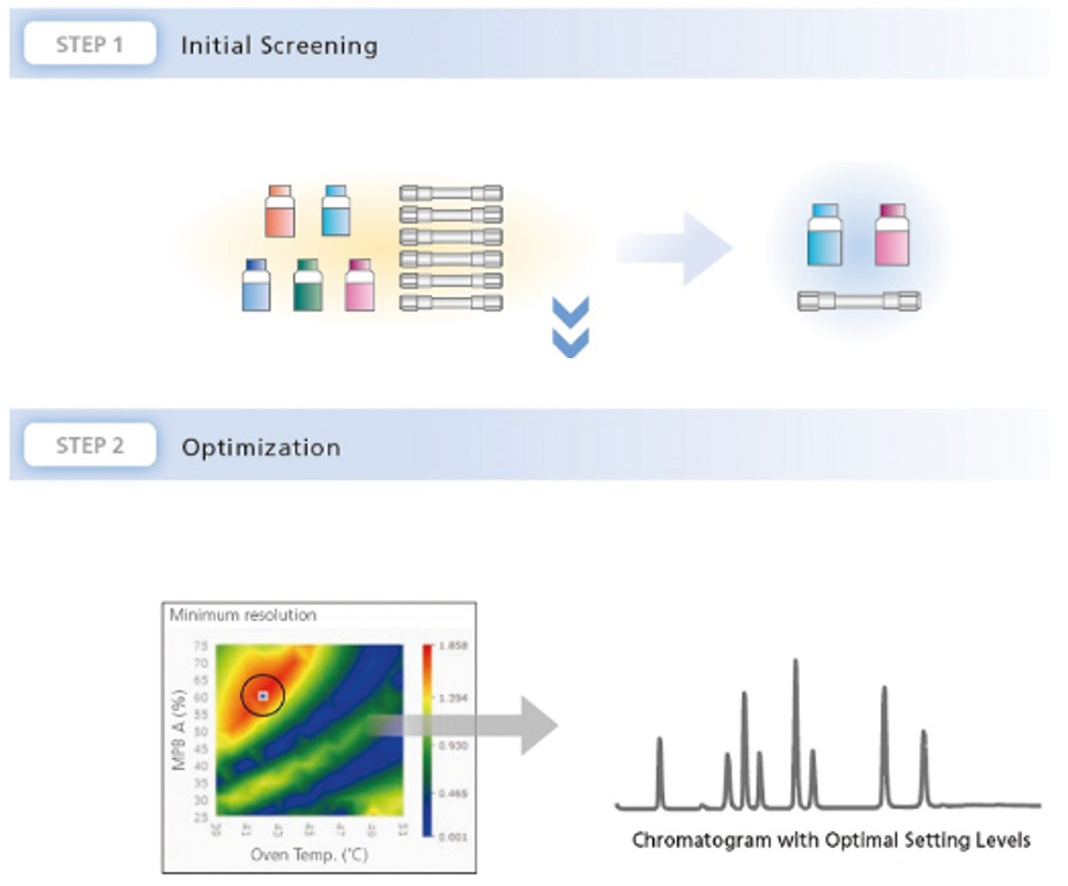
Wer schon einmal ein anspruchsvolles Puzzle gelegt hat, weiß: Nur mit einem Plan kommt man voran. Gleiches gilt auch für die Entwicklung einer Trennmethode. So wie man bei einem Puzzle zunächst die Teile mit den deutlichsten Unterschieden – Ecken, Randteile, farblich markante Teile – auswählt, steckt man zunächst die Rahmenbedingungen ab und prüft, welche Parameter überhaupt infrage kommen. Grundlage ist ein dreistufiges Vorgehensmodell: Screening, Datenauswertung, Optimierung.
Systematisches Screening: Säule, mobile Phase, Lösungsmittel
Die Puzzleteile sichten und vorsortieren: Es ist sinnvoll, zunächst über ein grobes Screening eine Vorauswahl zu treffen, ehe man sich in Details verliert. Ein zentraler Punkt ist die Säule, die bereits an die Eigenschaften der zu analysierenden Verbindung angepasst werden sollte.

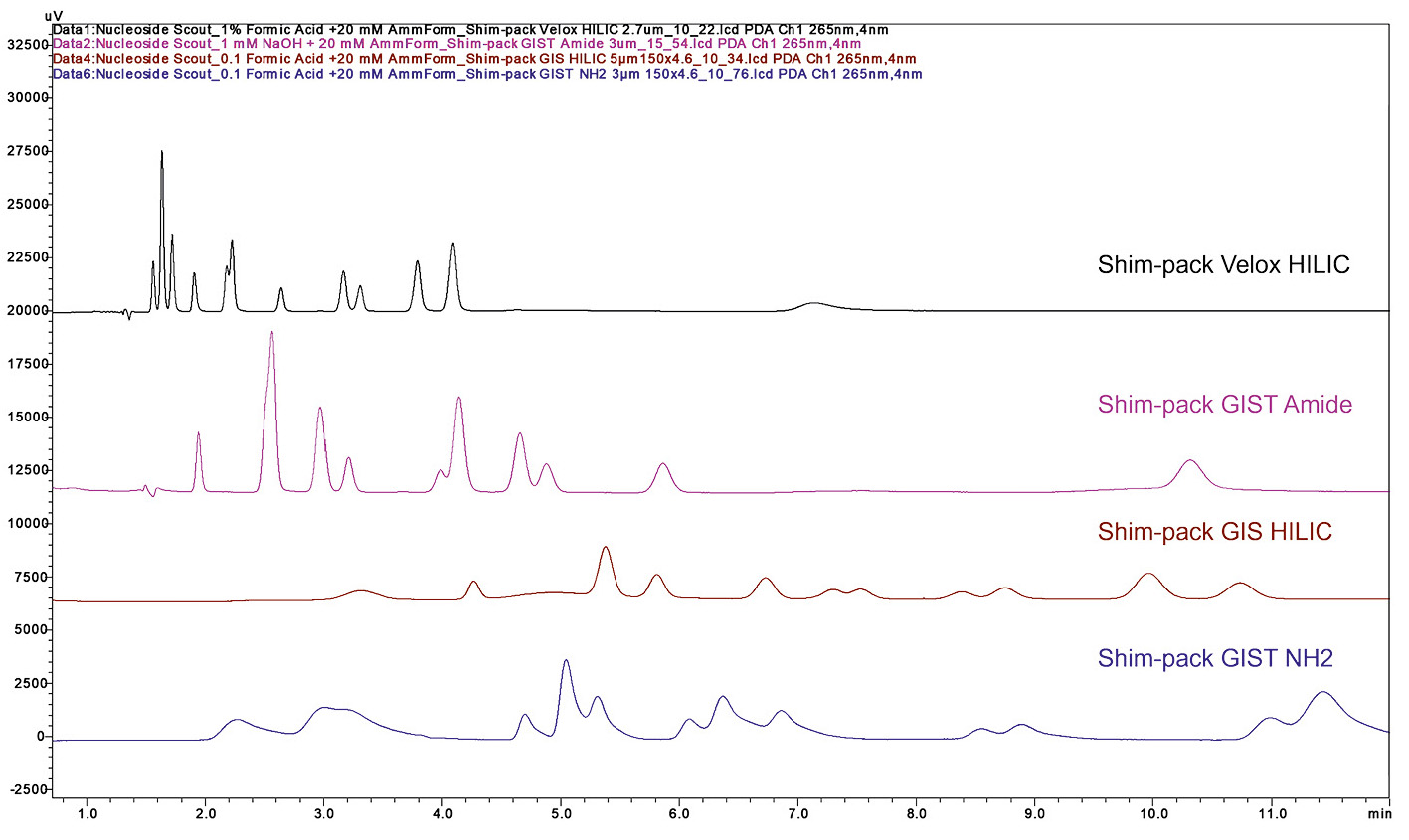
C18-Säulen bieten sich oft zum Start an, da sie sich für unpolare bis mittelpolare organische Verbindungen eignen und damit einen großen Teil der Substanzen abdecken. Sehr polare Verbindungen hingegen werden am besten auf polaren Säulen wie Amino- oder Silica-Säulen getrennt. Eine interessante Alternative stellt die HILIC-Methode (Hydrophilic Interaction Liquid Chromatography) dar, die sich speziell für stark polare Verbindungen eignet.
Eine gute Starthilfe ist die Shim-pack G series von Shimadzu: Ihre Säulenreihe umfasst 15 verschiedene stationäre Phasen und deckt damit eine große Bandbreite von Anwendungen ab. Diese Vielfalt erleichtert die Anpassung der Säulenauswahl an die spezifischen Anforderungen der Probe.
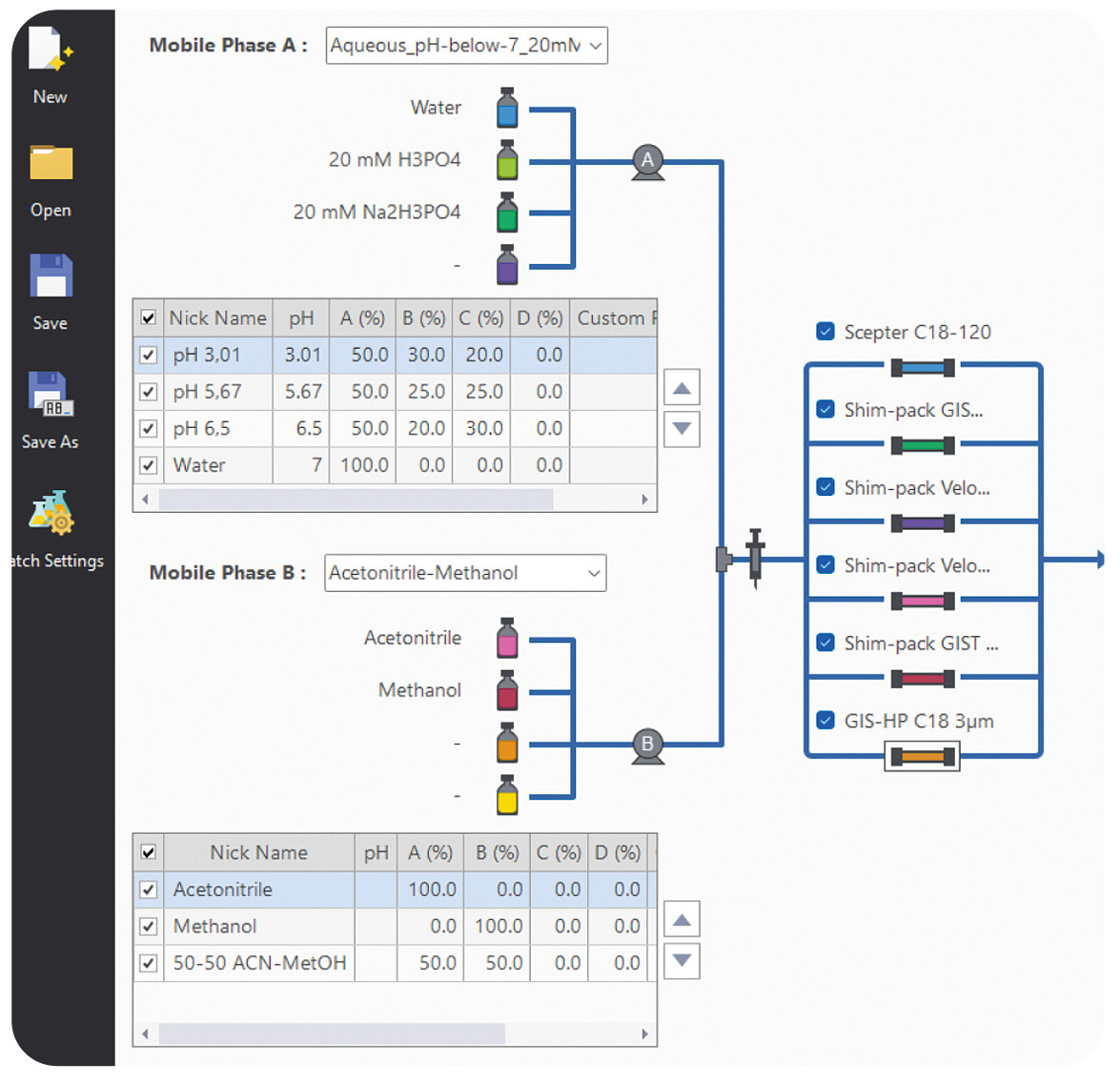
Neben der Säule spielt auch die Wahl der mobilen Phase eine entscheidende Rolle. Die Zusammensetzung der mobilen Phase beeinflusst nicht nur die Retention, sondern auch die Peakform und die Reproduzierbarkeit der Methode. Zusätze wie Säuren und Basen können die Trennleistung signifikant verbessern, während gepufferte Lösungen für eine stabile pH-Umgebung sorgen. Der pH-Wert ist besonders bei ionisierbaren Verbindungen von großer Bedeutung. Für maximale Flexibilität sorgen Säulen mit hoher pH-Resistenz wie die Shim-pack Scepter Säulen, da diese in einem pH-Bereich von 1 bis 12 eingesetzt werden können. Shimadzu bietet auch verschiedene Method Development Column Kits an, die eine Säulenauswahl für die Methodenentwicklung besonders einfach machen.
Ein weiterer wichtiger Faktor ist das passende Lösungsmittel. Hier ermöglicht Acetonitril oft schnellere Methoden und schmalere Peaks, während Methanol umweltfreundlicher ist.
Das Screening sollte entweder isokratisch, also bei gleichen Mischungsverhältnissen, oder mit einem einfachen linearen Gradienten, der von überwiegend wässriger zu überwiegend organischer mobiler Phase übergeht, stattfinden. Bei einer HILIC-Methode wäre dieses Verhältnis umgekehrt (Abbildung 1).

Method Development Tools: Unterstützung durch moderne Software
Mitspieler aktivieren: Um Zeit und Ressourcen zu sparen, kann man sich Unterstützung holen. Hier kommt LabSolutions MD ins Spiel. Die Softwarelösung speziell für das Method Development automatisiert den Prozess und vereinfacht ihn erheblich. Mithilfe der Software können in einfachen Schritten verschiedene Säulen und mobile Phasen kombiniert sowie Methodenparameter angepasst werden. Anschließend wird automatisch ein Batch generiert, das direkt vermessen werden kann (Abbildung 2).
Im Zusammenspiel mit einem Method Scouting System wird die Flexibilität weiter erhöht. Bis zu acht Lösungsmittel und zwölf Säulen können gleichzeitig verwendet werden. So lässt sich eine Vielzahl von Kombinationen testen, ohne die Hardware manuell umzurüsten. Das spart nicht nur Zeit, sondern schafft Struktur und ermöglicht eine systematische und reproduzierbare Herangehensweise.
| Response | |||
| Minimale Auflösung |
Peak- Anzahl |
Separierte Peak- Anzahl |
Bewer- tungs- wert |
| 0,333 | 12 | 5 | 346,938 |
| 0,282 | 12 | 5 | 324,437 |
| 0,318 | 10 | 5 | 274,349 |
| 0,3 | 10 | 5 | 266,437 |
| 0,232 | 9 | 5 | 242,192 |
| 0,291 | 8 | 5 | 208,444 |
| 0,141 | 8 | 5 | 208,195 |
Datenanalyse: Systematische Auswertung der Screening-Ergebnisse
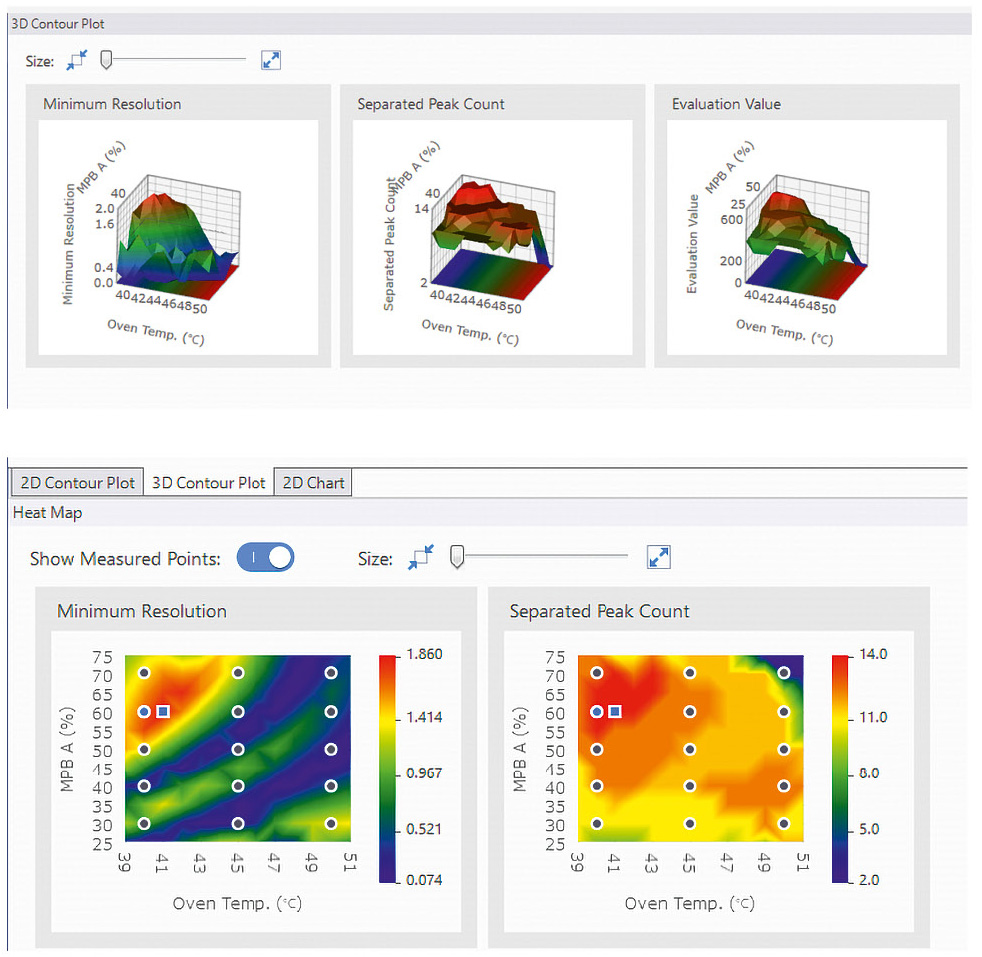
Den Rahmen legen: Die im Screening gewonnenen Daten sind der Schlüssel, um die besten Trennbedingungen zu identifizieren. Zur effizienten Auswertung der vielen Messungen bietet das Method Development System ein nutzerfreundliches Interface, das sich ideal für die Analyse solcher Screening-Daten eignet. Die Software bewertet die chromatographischen Ergebnisse nach mehreren Kriterien: Im Fokus stehen dabei die Auflösung zwischen den Peaks, die Anzahl der getrennten Peaks sowie die Gesamtzahl der erkannten Peaks. Besonders hilfreich hierbei: der Summenparameter „Evaluation Value“. Er multipliziert die Anzahl der getrennten Peaks mit der Auflösung. So lassen sich die besten Trennbedingungen auf einen Blick erkennen, ohne dass jedes Chromatogramm einzeln geprüft werden muss (Tabelle 1).
Optimierung: Von der Vorauswahl zum optimalen Gradienten
Nachdem der Rahmen des Puzzles steht, werden Motivgruppen gebildet: Die im Screening gewonnenen Daten bilden die Grundlage für den nächsten Schritt – die Optimierung der Methode. Dabei erfolgt eine gezielte Vorauswahl von Säule und mobilen Phasen. Dies reduziert die Anzahl der Variablen und ermöglicht eine fokussierte Verfeinerung der Methode.
Jetzt werden Parameter wie Temperatur, Fließgeschwindigkeit, Injektionsvolumen und Gradientenbedingungen systematisch variiert. Durch die damit verbundenen Verschiebungen der Retentionszeiten sammelt die Software Daten, mit denen sie ein präzises Modell der Trennung erstellt. Damit dieses Modell erfolgreich ist, muss die Software verstehen, welche Signale zu den jeweiligen Komponenten gehören. Dafür verfügt LabSolutions MD über eine Vielzahl von Zuordnungskriterien, die eine Modellerstellung unterstützen. So kann vorab simuliert werden, wie sich Methodenänderungen auswirken, ohne jede Variante experimentell testen zu müssen (Abbildung 3).
Nun geht es darum, die letzten fehlenden Teile exakt passend einzusetzen: Indem Parameter gegenübergestellt werden, können ideale Trenneigenschaften identifiziert werden. Die Software bietet hier eine Vielzahl von Grafiken und Interface-Unterstützungen (Abbildung 4).
Darüber hinaus kann ein optimierter Gradient berechnet werden, bei dem beispielsweise die schnellstmögliche Trennung oder die bestmögliche Auflösung entscheidend ist, je nach Anforderung der Analyse. Dieser Schritt spart nicht nur Zeit, sondern sorgt auch für höchste Effizienz der Methode (Abbildung 5).


Sobald der optimale Gradient berechnet wurde, führt die Software automatische Bestätigungsmessungen durch, um die Vorhersagen des Modells zu überprüfen. Sollten die Ergebnisse noch nicht den Erwartungen entsprechen, passt die Software die Bedingungen weiter an und wiederholt die Messungen (Abbildung 6).
Die Kombination aus modellbasierter Optimierung und automatisierter Kontrolle sorgt dafür, dass die entwickelte Methode nicht nur präzise und reproduzierbar ist, sondern auch den spezifischen Anforderungen der Analyse passgenau entspricht. Dieser Ansatz ist besonders wertvoll bei der Trennung komplexer Proben, da er eine hohe Flexibilität und Effizienz bietet.
Die Auswahl der richtigen Parameter in der Methodenentwicklung ähnelt dem Einsetzen der ersten markanten Puzzlestücke: Sind sie gefunden, fügt sich der Rest deutlich leichter. Moderne Software, Systeme und Säulen erleichtern genau diesen Schritt, machen das Screening effizient und die Ergebnisse reproduzierbar. Darauf aufbauend passt die modellbasierte Optimierung die Methode präzise an die jeweilige Fragestellung an. Am Ende greifen alle Teile ineinander und ergeben ein klares Bild: So lassen sich selbst komplexe analytische Herausforderungen zuverlässig meistern. Aufgabe erledigt – Puzzle gelöst.