Den Lebensgewohnheiten unserer Vorfahren auf der Spur
Nachweis von Lipiden in archäologischen Tongefäßen mithilfe von HPLC-MS und GCMS
Den Lebensgewohnheiten unserer Vorfahren auf der Spur
Nachweis von Lipiden in archäologischen Tongefäßen mithilfe von HPLC-MS und GCMS
Valentina Chiaia, PhD Danilo Donnarumma, PhD Giuseppe Micalizzi, PhD Anna Irto,
Prof. Clemente Bretti, Prof. Paola Cardiano, Prof. Luigi Mondello, Universität von Messina
Lipide, also Fette, sind die wichtigsten organischen Verbindungen, die in antiken Tongefäßen nachgewiesen werden können. Dies hängt damit zusammen, dass sie länger unverändert erhalten blieben als andere organische Verbindungen wie Kohlenhydrate und Proteine. Dennoch kann es auch bei Lipiden zu Änderungsprozessen wie thermischer Zersetzung, Oxidation oder Hydrolyse kommen. Um die Zersetzungsprozesse von Lipiden in ausgegrabenen Tongefäßen zu simulieren, wurde im Rahmen dieser Studie ein künstliches Alterungsverfahren eingesetzt. Die verschiedenen Lipidarten wurden mithilfe von HPLC-MS- und GCMS-Verfahren getrennt und detektiert.
Was Fettrückstände in antiken Tongefäßen über frühere Essgewohnheiten aussagen
Die Analyse organischer Rückstände in ausgegrabenen Tongefäßen lässt entscheidende Rückschlüsse auf das Alltagsleben in antiken Gesellschaften zu. Das organische Material wird von Tongefäßen absorbiert und überdauert dort über Jahrtausende vollständig oder teilweise, woraus sich wertvolle Erkenntnisse über die Verwendung verschiedener natürlicher Rohstoffe gewinnen lassen. Durch analytische Untersuchungen an Spuren von organischer Materie, sichtbaren organischen Rückständen, Ablagerungen oder Krusten lässt sich nicht nur deren Ursprung ermitteln, sondern auch die Funktion und Verwendung der Tongefäße bestimmen. So lassen sich zahlreiche Fragen zur menschlichen Lebensweise in der Antike beantworten.
Der Fokus der Forscher liegt vor allem auf Lipiden, also Fettrückständen, da diese ihre Stabilität beibehalten im Gegensatz zu anderen organischen Verbindungen wie Kohlenhydraten oder Proteinen [1]. Da Lipide größtenteils wasserunlöslich sind, ist die Perkolation über die Jahrhunderte tatsächlich stark eingeschränkt, sodass sie dort verbleiben, wo sie sich ursprünglich abgelagert haben. Polare Stoffe dagegen zersetzen sich eher, vor allem solche, die Stickstoff- und Phosphoratome aufweisen [2]. Obwohl sich Lipide aufgrund ihrer hydrophoben Eigenschaften potenziell ausgezeichnet als „archäologische Biomarker“ eignen [3], können sie sich durch das Vorkommen von reaktiven funktionellen Gruppen in den molekularen Strukturen verändern. Zudem hängt die Lipidkonservierung sehr stark von den Umweltbedingungen ab (z. B. überdauern Lipide besser bei trockenem Klima [4]) und von dem Material, in dem sie eingeschlossen sind. Sehr dichte oder vitrifizierte Materialien mindern aufgrund ihrer geringen Porosität und Durchlässigkeit die Zersetzung, wohingegen Oberflächen, die große Mengen Wasser und anderer reaktiver Stoffe enthalten, chemische Zersetzungsprozesse wie Hydrolyse oder Oxidation in Gang setzen können [5].


Ein Blick in die Kochtöpfe der Antike – Unterscheidung zwischen marinen und terrestrischen Zutaten
Durch Simulation der thermischen Zersetzung, Oxidation oder Hydrolyse von Lipiden lassen sich wertvolle Erkenntnisse gewinnen, um die Herkunft tierischer Fette und pflanzlicher Öle, die im Laufe der Zeit teilweise oder vollständig verändert wurden, besser zu interpretieren [3]. In früheren Studien wurde die beschleunigte Alterung genutzt, um die natürliche Veränderung von Lipiden an der Ausgrabungsstätte zu simulieren. So konnten Colombini et al [6] nachweisen, dass die wichtigsten Oxidationsprodukte von einfach ungesättigten Fettsäuren (MUFAs) wie Gondosäure (C20:1n9) und Erucasäure (C22:1n9), die vor allem im Öl von Brassica juncea reichlich vorkommen, (α,ω)-Undecan- und (α,ω)-Tridecansäuren waren. Demnach ist die molekulare Struktur von Oxidationsprodukten stark von der Position der Doppelbindung in der Kohlenstoffkette der nativen Fettsäure abhängig. Darüber hinaus haben Bondetti et al. [7] ein neuartiges Kriterium zur Unterscheidung mariner und terrestrischer Naturprodukte auf Grundlage der molekularen Struktur langkettiger ω‐(o‐Alkylphenyl)Alkansäuren (APAAs) vorgeschlagen, bei denen es sich um Oxidationsprodukte von Fettsäuren mit mehreren Doppelbindungen handelt. So konnte beispielsweise ein direkter Zusammenhang zwischen APAA mit 20 und 22 Kohlenstoffatomen und dem Kochen von Wasserorganismen hergestellt werden [8], da diese von Eicosapentaensäure (C20:5n3) und Docosahexaensäure (C22:6n3) stammen, die besonders reichlich in Fisch vorkommen.
Einsatz von GC und HPLC mit MS-Kopplung zur Trennung gealterter Lipide
In Alterungsstudien kommen in der Regel hochauflösende chromatographische Verfahren mit Massenspektrometrie-Kopplung (MS) zum Einsatz. Die Änderungs- bzw. Zersetzungsprodukte werden zunächst auf Grundlage ihrer Wechselwirkung mit mobilen und stationären Phasen getrennt und anschließend in der MS-Dimension erfasst. Die relative Retentionszeit (linearer Retentionsindex, LRI) und das Fragmentierungsmuster können daher genutzt werden, um die Identität der unbekannten Lipidverbindungen eindeutig zu bestimmen. Das Hauptziel dieser Studie ist die Entwicklung von Analyseverfahren durch Einsatz der Gaschromatographie (GC) und der Hochleistungsflüssigkeitschromatographie (HPLC) mit Massenspektrometrie-Kopplung (MS) zur Trennung und Identifikation gealterter Lipide. Mithilfe thermisch-oxidativer Behandlungen im Labor wurde die natürliche Zersetzung von Olivenöl simuliert, das traditionell in antiken Gesellschaften im Mittelmeerraum verwendet wurde.


Materialien und Methoden
Tristearin-(SSS)-, Triolein-(OOO)- und Trilinolein-(LLL)-Standards (10 mg) wurden drei Wochen lang bei 120 °C in einen Ofen gegeben. Die thermisch-oxidative Behandlung wurde auch an 10 mg Olivenöl extra nativ durchgeführt.
Intakte gealterte Lipide wurden zunächst in 2-Propanol (1.000 mg/L-1) verdünnt und 1 µl davon wurde direkt in ein Nexera X2 Ultra-Hochleistungs-Flüssigkeitschromatographie-System (UHPLC) mit zwei parallelen Doppelkolben-Pumpen LC-30 AD, einem DGU-20A5R Entgaser, einem CTO-20AC Säulenofen und einem SIL-30AC Autosampler injiziert.
Das UHPLC-System war an ein LCMS-8060 Triple-Quadrupol-Massenspektrometer mit APCI-Interface gekoppelt.
Als Trennverfahren wurde die nicht wässrige Umkehrphasen-Hochleistungsflussigkeitschromatographie (NARP-HPLC) mit 2 Ascentis Express C18 Säulen (100 mm L × 2,1 mm ID, 2,7 μm Partikelgrose) angewendet. Die mobile Phase bestand aus: (A) Acetonitril und (B) 2-Propanol mit einer Flussrate von 0,4 ml/min-1. Die chromatographische Trennung erfolgte mit diesem Gradienten: 0–105 min, 0–50 % B, für 20 min. Die MS-Parameter waren: m/z-Bereich 250–1.200; Ereigniszeit 0,2 s; Flussrate Verneblungsgas (N2) 3 l/min-1; Flussrate Trockengas (N2) 5 l/min-1; Interface-Temperatur 350 °C; DL-Temperatur 200 °C; Heizblocktemperatur 200 °C.
Die Daten wurden mit der LabSolution Software erfasst und verarbeitet. Für die LRI-Berechnung wurde das Triacylglycerol (TG)-Gemisch mit ungerader Kohlenstoffzahl von C9C9C9 bis C17C17C17 als homologe Reihen zu Referenzzwecken genutzt [9].
GC-Analysen
Gealterte Lipide wurden zunächst in Trimethylsilyl-(TMS)-Derivate umgewandelt, um die Flüchtigkeit zu erhöhen und die Polarität zu verringern. Zu diesem Zweck wurden alle Proben mit 200 µl N,O-Bis(trimethylsilyl)trifluoroacetamid (BSTFA) als Reagenz mit 1 % Chlor(trimethyl)silan (TMCS) und 500 µl Dichloromethan (CH2Cl2) derivatisiert. Anschließend wurde das Reaktionsgemisch für 20 min bei 80 °C erhitzt. Die Trennung und Identifikation der Fettsäuren erfolgte mithilfe eines GCMS-QP2020 NX Systems.
Die Proben wurden automatisch mithilfe eines AOC-20i Autosamplers injiziert. Ein Split/Splitless-Injektor wurde am GCMS-Instrument installiert. Die Trennung von TMS-Derivaten erfolgte durch Einsatz einer unpolaren Kapillarsäule vom Typ SLB-5ms (entspricht in der Polarität der Poly(5%-diphenyl-95%-dimethylsiloxan)-Phase) 30 m x 0,25 mm ID x 0,25 μm df. Das Temperaturprogramm war: 50 °C bis 360 °C bei 3 °C/min-1. Das Injektionsvolumen und das Split-Verhältnis betrugen: 0,5 μl im splitlosen Betrieb. Als Trägergas wurde Helium mit einer konstanten linearen Geschwindigkeit von 30 cm/sec-1 verwendet. Die MS-Parameter waren: Elektronenionisation (70 eV); Ionenquellen-Temperatur: 250 °C; Massenbereich: m/z 40–650; Interface-Temperatur: 250 °C. Für die LRI-Berechnung wurde ein gesättigtes C7-C40-Alkan-Standardgemisch verwendet. Die GCMSsolution Software wurde sowohl für die Datenerfassung als auch -verarbeitung genutzt.


Ergebnisse und Diskussion
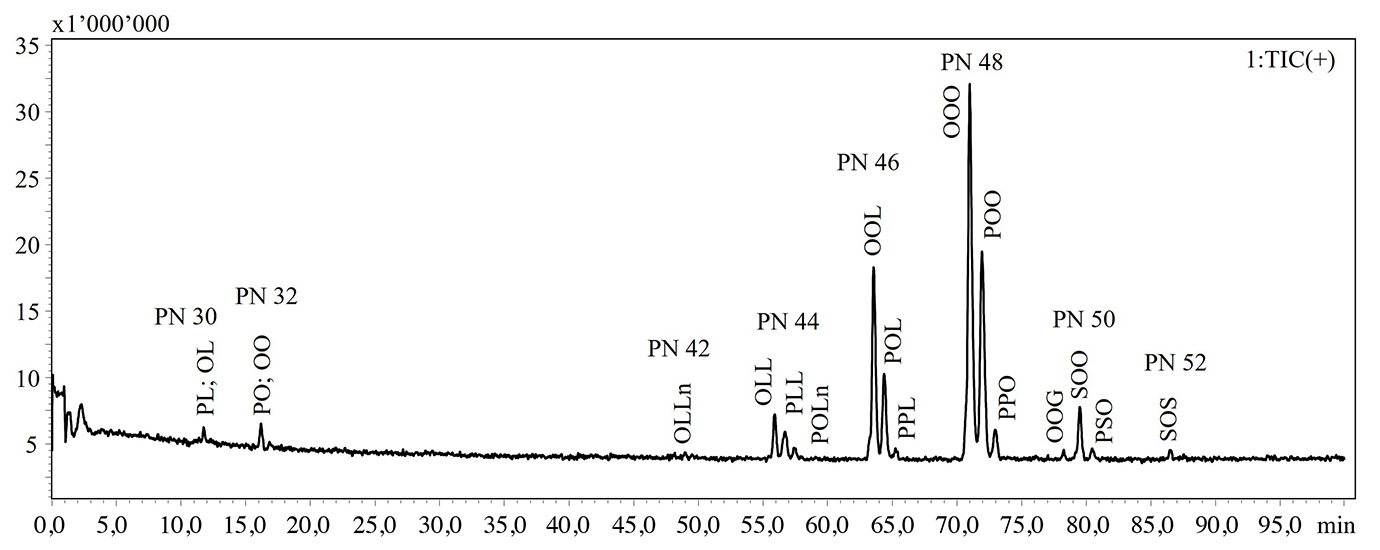
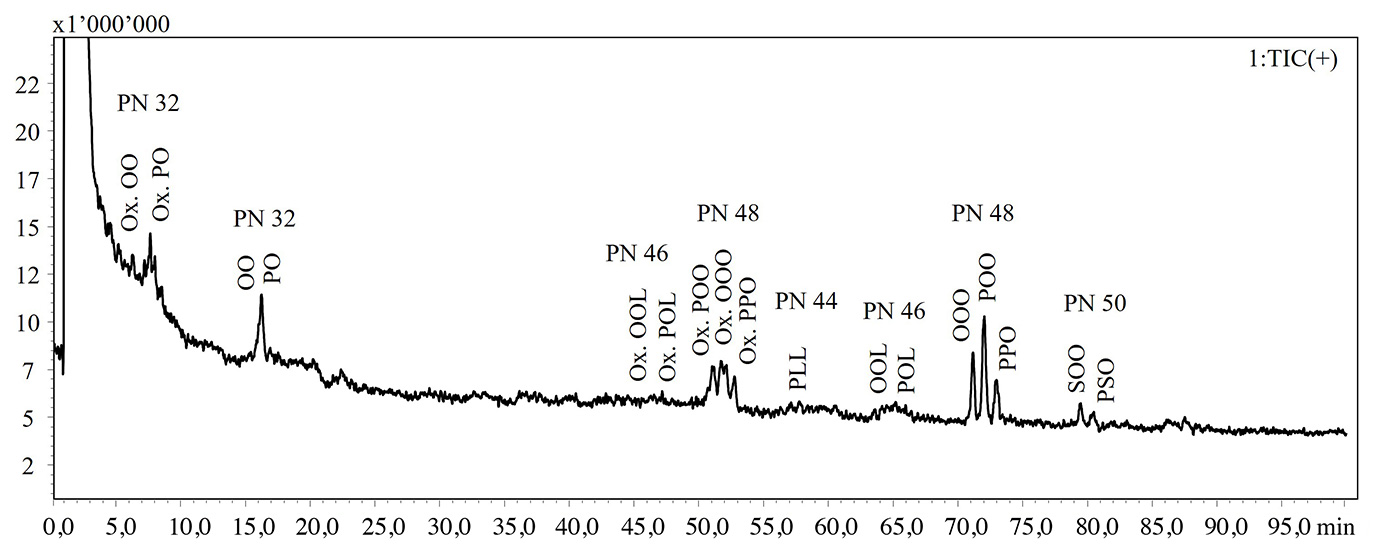
In der vorliegenden Studie wurde ein NARP-HPLC-Verfahren mit MS-Kopplung via APCI-Interface für die Analyse intakter Lipide in TG-Standards und thermisch-oxidativ behandeltem Olivenöl extra nativ angewendet. Abbildung 1 zeigt die HPLC-MS-Chromatogramme der intakten Lipide in nicht gealtertem und gealtertem Olivenöl. Die Elution der Lipidarten erfolgt entsprechend dem Anstieg der Verteilungszahl (PN) aus der Gleichung PN = CN – 2DB, wobei CN und DB für die Anzahl der Kohlenstoffatome bzw. die Anzahl der Doppelbindungen der Fettsäure stehen. Die Identifikation der Lipide erfolgte nach Oteri et al. [9], in der zwei verschiedene Identifikationskriterien herangezogen wurden: MS-Fragmentierungsmuster und LRIs. In Tabelle 1 sind die identifizierten Lipide und die Retentionszeiten (RT), detektierte Ionen, experimentelle und Referenz-LRIs für jede Lipidart aufgeführt. Um die Übereinstimmung der experimentellen LRIs zu bewerten, wurde eine im Labor erstellte Datenbank mit LRI-Werten genutzt.
Die NARP-HPLC-APCI-MS-Analyse zeigte die Bildung oxidierter Lipidarten, gekennzeichnet durch eine Massenzunahme um 16 Dalton (dem molekularen Gewicht eines Sauerstoffatoms), wie in Tabelle 1 dargestellt.
|
RT |
[M-H2O+H]+ |
[M+H]+ |
[M+NH4]+ |
Diagnostische Fragmente |
Klasse |
CN : DB |
Verbindung |
PN |
LRIexp |
LRIref |
Nicht gealtert |
Gealtert |
|
7,92 |
593,5 |
611,5 |
313,3 355,3 |
Ox. DG |
34 : 1 |
Ox. PO |
32 |
2.844 |
– |
nd |
x |
|
|
8,28 |
619,5 |
637,5 |
339,3 355,3 |
Ox. DG |
36 : 2 |
Ox. OO |
32 |
2.865 |
– |
nd |
x |
|
|
12,13 |
575,5 |
313,3 337,3 |
DG |
34 : 2 |
PL |
30 |
3.089 |
– |
x |
nd |
||
|
12,13 |
601,5 |
337,3 339,3 |
DG |
36 : 3 |
OL |
30 |
3.089 |
– |
x |
nd |
||
|
16,72 |
577,5 |
313,3 339,3 |
DG |
34 : 1 |
PO |
32 |
3.327 |
– |
x |
x |
||
|
16,72 |
603,5 |
339,3 |
DG |
36 : 2 |
OO |
32 |
3.327 |
– |
x |
x |
||
|
47,84 |
899,7 |
916,7 |
617,5 619,5 |
Ox. TG |
54 : 4 |
Ox. OOL |
46 |
4.144 |
– |
nd |
x |
|
|
49,31 |
873.7 |
890,7 |
591,5 593,5 617,5 |
Ox. TG |
52 : 3 |
Ox. POL |
46 |
4.178 |
– |
nd |
x |
|
|
49,68 |
879,7 |
896,7 |
597,5 599,5 601,5 |
TG |
54 : 6 |
OLLn |
42 |
4.187 |
4.192 |
x |
nd |
|
|
52,38 |
875,7 |
593,5 619,5 |
Ox. TG |
52 : 2 |
Ox. POO |
48 |
4.249 |
– |
nd |
x |
||
|
53,07 |
901,7 |
918,7 |
619,5 |
Ox. TG |
54 : 3 |
Ox. OOO |
48 |
4.265 |
– |
nd |
x |
|
|
54,05 |
849,7 |
593,5 |
Ox. TG |
50 : 1 |
Ox. PPO |
48 |
4.288 |
– |
nd |
x |
||
|
56,65 |
881,7 |
898,7 |
599,5 601,5 |
TG |
54 : 5 |
OLL |
44 |
4.348 |
4.342 |
x |
nd |
|
|
57,44 |
855,7 |
872,7 |
575,5 599,5 |
TG |
52 : 4 |
PLL |
44 |
4.366 |
4.358 |
x |
x |
|
|
58,25 |
855,7 |
872,7 |
573,5 577,5 599,5 |
TG |
52 : 4 |
POLn |
44 |
4.385 |
4.383 |
x |
nd |
|
|
64,28 |
883,7 |
900,7 |
601,5 603,5 |
TG |
54 : 4 |
OOL |
46 |
4.528 |
4.516 |
x |
x |
|
|
65,16 |
857,7 |
874,7 |
575,5 577,5 601,5 |
TG |
52 : 3 |
POL |
46 |
4.551 |
4.539 |
x |
x |
|
|
66,06 |
831,7 |
848,7 |
551,4 575,4 |
TG |
50 : 2 |
PPL |
46 |
4.574 |
4.571 |
x |
nd |
|
|
71,69 |
885,7 |
902,7 |
603,5 |
TG |
54 : 3 |
OOO |
48 |
4.722 |
4.729 |
x |
x |
|
|
72,73 |
859,7 |
876,7 |
603,5 577,5 |
TG |
52 : 2 |
POO |
48 |
4.749 |
4.756 |
x |
x |
|
|
73,81 |
833,7 |
850,7 |
551,5 577,5 |
TG |
50 : 1 |
PPO |
48 |
4.777 |
4.776 |
x |
x |
|
|
78,91 |
913,8 |
930,8 |
603,5 631,5 |
TG |
56 : 3 |
OOG |
50 |
4.911 |
4.905 |
x |
nd |
|
|
80,23 |
887,7 |
904,7 |
603,5 605,5 |
TG |
54 : 2 |
SOO |
50 |
4.945 |
4.948 |
x |
x |
Tabelle 1: Liste der in nicht gealtertem und gealtertem Olivenöl identifizierten Lipidarten (x: detektiert; nd: nicht detektiert)
Legende: Ox. DG: oxidiertes Diacylglycerol; DG: Diacylglycerol; Ox. TG: oxidiertes Triacylglycerol; TG: Triacylglycerol
Abkürzungen: RT: Retentionszeit; [M-H2O+H]+, [M+H]+, [M+NH4]+ und diagnostische Fragmente: detektierte Ionen; Klasse: Lipidklasse; CN : DB: Kohlenstoffnummer : Doppelverbindung; PN: Verteilungszahl; LRIexp: experimenteller LRI; LRIref: Referenz-LRI
Abb. 1: HPLC-MS-Chromatogramme intakter Lipide, die in nicht gealtertem (oben) und gealtertem (unten) Olivenöl extra nativ nachgewiesen wurden
Legende: Ox. DG: oxidiertes Diacylglycerol; DG: Diacylglycerol; Ox. TG: oxidiertes Triacylglycerol; TG: Triacylglycerol
Abkürzungen: P: Palmitinsäure; S: Stearinsäure; O: Ölsäure; L: Linolsäure; Ln: Linolensäure; A: Arachinsäure; G: Gondosäure
Abb. 1: HPLC-MS-Chromatogramme intakter Lipide, die in nicht gealtertem (oben) und gealtertem (unten) Olivenöl extra nativ nachgewiesen wurden
Legende: Ox. DG: oxidiertes Diacylglycerol; DG: Diacylglycerol; Ox. TG: oxidiertes Triacylglycerol; TG: Triacylglycerol.
Abkürzungen: P: Palmitinsäure; S: Stearinsäure; O: Ölsäure; L: Linolsäure; Ln: Linolensäure; A: Arachinsäure; G: Gondosäure.
Festgestellt werden konnte ein signifikanter Verlust der am häufigsten vorkommenden TGs wie z. B. Triolein (OOO), was wahrscheinlich im Zusammenhang mit der Bildung freier Fettsäuren steht, wie die GC-Analysen bestätigten.
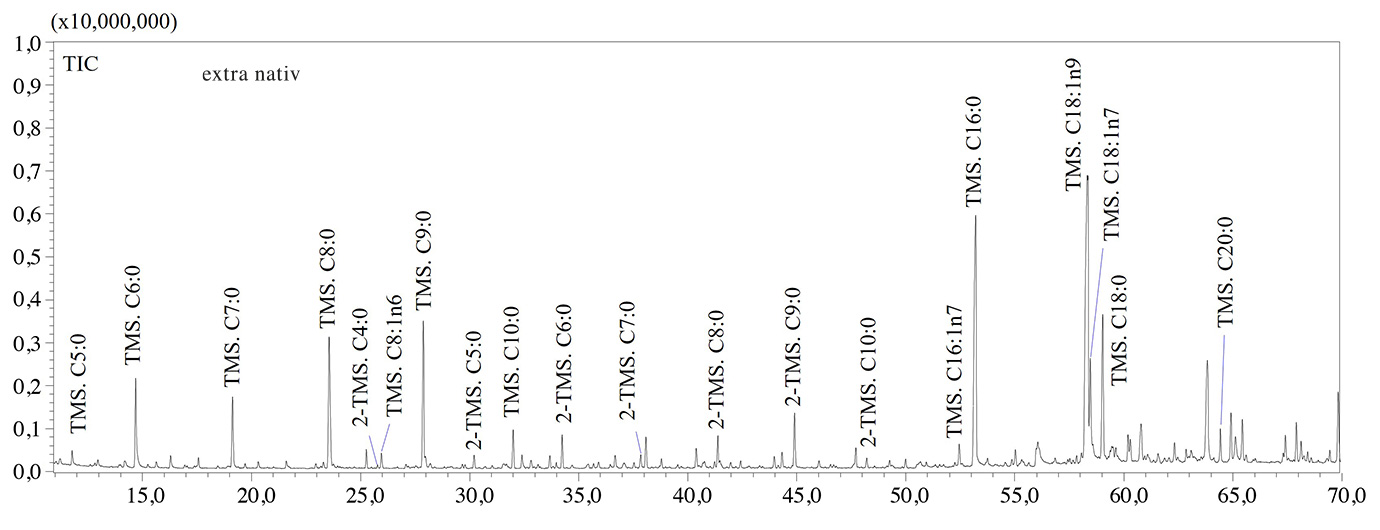
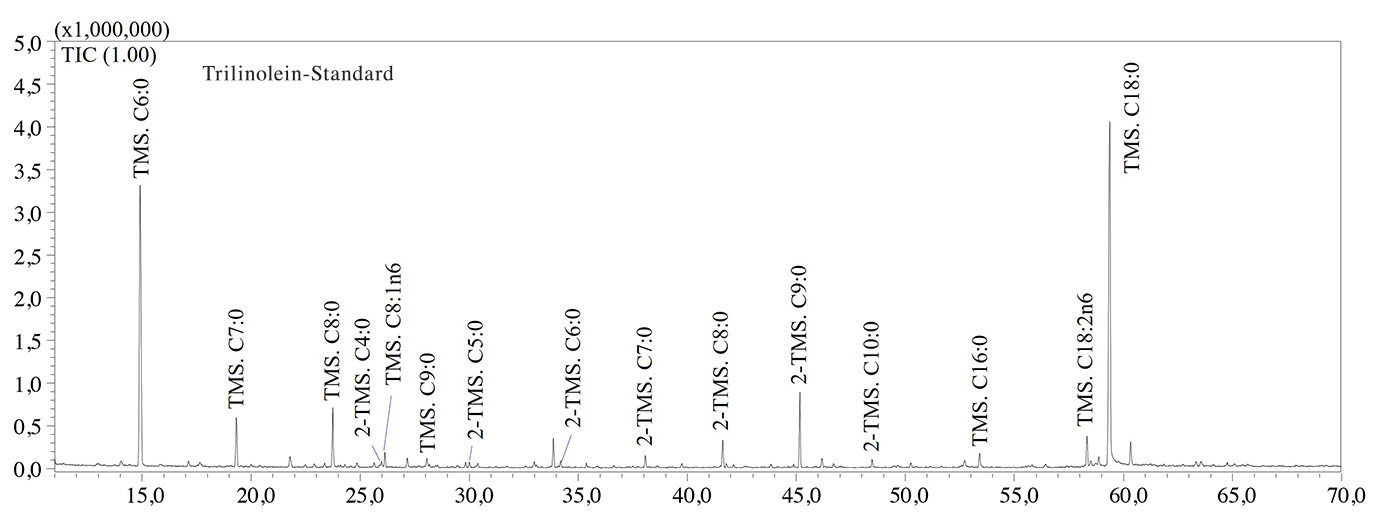
Die GCMS-Analysen bestätigten, dass thermisch-oxidative Behandlungen zur Bildung großer Mengen an kurzkettigen Fettsäuren (SCFAs) mit einer Anzahl von Kohlenstoffatomen von 5 bis 9 Einheiten führten. Capronsäure (C6:0), Önanthsäure (C7:0), Octansäure (C8:0) und Pelargonsäure (C9:0) waren die am häufigsten in gealtertem Olivenöl vorkommenden SCFAs, wie die GCMS-Chromatogramme in Abbildung 2 zeigen. Die thermisch-oxidative Behandlung führte zum Einbau eines Sauerstoffatoms in die Kohlenstoffkette, zur Spaltung der Doppelbindung sowie zur Bildung von Lipidarten mit geringerem molekularen Gewicht, wie auch Colombini et al feststellten [6]. So erfolgte der Nachweis von C9:0 in gealtertem Olivenöl aufgrund der Spaltung der Doppelbindung an der Position C-9 von Ölsäure, während die große Menge an C6:0 durch die Spaltung der Doppelbindung an der Position C-6 der Kohlenstoffkette von Linolsäure (C18:2n6) entstand (Abbildung 2).
In Bezug auf Tristearin zeigte das GCMS-Chromatogramm (nicht dargestellt) die hohe Stabilität der Verbindung aufgrund fehlender Doppelbindungen in der Kohlenstoffkette. Deshalb sind Fettsäuren mit mindestens einer Doppelbindung anfälliger gegenüber oxidativem Stress. Laut Literaturdaten [6] wurden schließlich auch (α,ω)-Dicarbonsäuren wie Adipin-, Pimelin-, Kork-, Azelain- und Sebacinsäure in gealterten Proben nachgewiesen (Abbildung 2). Aufgrund ihrer geringeren Flüchtigkeit im Vergleich zu SCFAs kommen (α,ω)-Dicarbonsäuren als potenzielle archäologische Biomarker infrage, obgleich weitere Untersuchungen erforderlich sind, um typische Biomarker für Olivenöl zu identifizieren. In Tabelle 2 werden die Fettsäuren (als TMS-Derivate) aufgeführt, die in den analysierten Proben nachgewiesen wurden.

|
Verbindung |
MS-Ähnlichkeit |
LRIexp |
LRIref |
|
Valeriansäure; TMS. C5:0 |
89 |
980 |
974 |
|
Capronsäure; TMS. C6:0 |
93 |
1.072 |
1.069 |
|
Önanthsäure; TMS. C7:0 |
93 |
1.167 |
1.166 |
|
Octansäure; TMS. C8:0 |
92 |
1.262 |
1.262 |
|
Bernsteinsäure; 2-TMS. C4:0 |
92 |
1.312 |
1.310 |
|
2-Octensäure; TMS. C8:1n6 |
93 |
1.316 |
– |
|
Pelargonsäure; TMS. C9:0 |
89 |
1.359 |
1.358 |
|
Glutarsäure; 2-TMS. C5:0 |
90 |
1.404 |
1.403 |
|
Caprinsäure; TMS. C10:0 |
90 |
1.456 |
1.456 |
|
Adipinsäure; 2-TMS. C6:0 |
88 |
1.504 |
1.503 |
|
Pimelinsäure; 2-TMS. C7:0 |
90 |
1.602 |
1.601 |
|
Korksäure; 2-TMS. C8:0 |
88 |
1.696 |
1.694 |
|
Azelainsäure; 2-TMS. C9:0 |
91 |
1.795 |
1.792 |
|
Sebacinsäure; 2-TMS. C10:0 |
90 |
1.891 |
1.889 |
|
Palmitelaidinsäure; TMS. C16:1n7 |
96 |
2.023 |
– |
|
Palmitinsäure; TMS. C16:0 |
89 |
2.045 |
2.043 |
|
Linolensäure; TMS. C18:2n6 |
96 |
2.207 |
– |
|
Stearinsäure; C18:0 |
93 |
2.168 |
– |
|
Oleinsäure; TMS. C18:1n9 |
93 |
2.215 |
2.207 |
|
cis-Vaccensäure; TMS. C18:1n7 |
95 |
2.222 |
2.226 |
|
Stearinsäure; TMS. C18:0 |
97 |
2.243 |
2.237 |
|
Arachinsäure; TMS. C20:0 |
96 |
2.440 |
2.437 |
Tabelle 2: Liste der in gealterten Proben als TMS-Derivate nachgewiesenen Fettsäureverbindungen. Abkürzungen: MS-Ähnlichkeit: massenspektrale Ähnlichkeit; LRIexp: experimenteller LRI; LRIref: Referenz-LRI.
Die zurückgelassenen Geheimnisse antiken Lebens lüften
Für die Analyse und Detektion der wichtigsten Oxidations- und Zersetzungsprodukte von thermisch-oxidativ behandeltem Olivenöl extra nativ wurden sowohl HPLC-MS- als auch GCMS-Verfahren angewandt. Um die genaue Identität der chromatographischen Peaks festzustellen, wurden zwei verschiedene Kriterien herangezogen: MS-Fragmentierungsmuster und LRIs. Diese Strategie erlaubt die Bestimmung potenzieller archäologischer Biomarker, die nützlich sind, um den Ursprung von tierischen Fetten und pflanzlichen Ölen genauer zu interpretieren, die von antiken Gesellschaften verwendet wurden und sich im Laufe der Zeit teilweise oder vollständig veränderten. Insbesondere mithilfe des HPLC-MS-Verfahrens ließ sich die Oxidation auf Ebene von intakten Lipiden bewerten. Das GCMS-Verfahren dagegen spielte eine entscheidende Rolle für die Identifikation von Lipidarten mit geringem molekularen Gewicht wie z. B. SCFAs und (α,ω)-Dicarbonsäuren. Die angewandten Verfahren erwiesen sich als besonders valide und zuverlässig für die Charakterisierung von gealterten bzw. zersetzten Lipidarten im archäologischen Kontext.

Literatur
- Stern, B.; Heron, C.; Tellefsen, T.; Serpico, M., New investigations into the Uluburun resin cargo. J. Archaeol. Sci. 2008, 35, (8), 2188-2203.
- Evershed, R.P. Organic residue in archaeology: The archaeological biomarker revolution. Archaeometry. 2008, 50, 895–924.
- Irto, A.; Micalizzi, G.; Bretti, C.; Chiaia, V.; Mondello, L.; Cardiano, P. Lipids in Archaeological Pottery: A Review on Their Sampling and Extraction Techniques. Molecules. 2022, 27, 3451.
- Copley, M.S.; Bland, H.A.; Rose, P.; Horton, M.; Evershed, R.P. Gas chromatographic, mass spectrometric and stable carbon isotopic investigations of organic residues of plant oils and animal fats employed as illuminants in archaeological lamps from Egypt. Analyst. 2005, 130, 860–871.
- Jones, M.K.; Briggs, D.E.G.; Eglington, G.; Hagelberg, E.; Evershed, R.P.; Dudd, S.N.; Charters, S.; Mottram, H.; Stott, A.W.; Raven, A.; et al. Lipids as carriers of anthropogenic signals from prehistory. Philos. Trans. R. Soc. Lond. B Biol. Sci. 1999, 354, 19–31.
- Colombini, M. P.; Giachi, G.; Modugno, F.; Ribechini, E. Characterisation of organic residues in pottery vessels of the Roman age from Antinoe (Egypt). Microchemical Journal. 2005, 79, 83–90.
- Bondetti, M.; Scott, E.; Courel, B.; Lucquin, A.; Shoda, S.; Lundy, J.; Labra-Odde, C.; Drieu, L.; Craig, O.E. Investigating the formation and diagnostic value of ω-(o-alkylphenyl)alkanoic acids in ancient pottery. Archaeometry. 2020, 63, 594–608.
- Cramp, L.J.E.; Evershed, R.P. Reconstructing Aquatic Resource Exploitation in Human Prehistory Using Lipid Biomarkers and Stable Isotopes; Elsevier: Oxford, UK, 2014.
- Oteri, M.; Rigano, F.; Micalizzi, G.; Casale, M.; Malegori, C.; Dugo, P.; Mondello, L. Comparison of lipid profile of Italian Extra Virgin Olive Oils by using rapid chromatographic approaches. J. Food Compos. Anal. 2022, 110, 104531.