Wie durch eine Spektralbrille – einzelne Farben im weißen Licht erkennen
Wie durch eine Spektralbrille – einzelne Farben im weißen Licht erkennen

Lösen von Koelutionsherausforderungen bei der Betablocker-Trennung mit i-PDeA II
Oktawia Kalisz and DSc Szymon Bocian, Nicolaus Copernicus University in Toruń


In der Flüssigchromatographie stellt die Trennung von strukturell ähnlichen Verbindungen wie Betablockern aufgrund häufiger Koelution eine Herausforderung dar. Im vorliegenden Artikel wird ein Versuch beschrieben, acht Betablocker in einem komplexen Gemisch zu identifizieren, ohne jede Verbindung mühsam einzeln injizieren zu müssen. Das konkrete Ziel bestand darin, eine schnellere und effizientere Methode zur Auflösung überlappender Peaks mithilfe digitaler Tools zu finden.
Am Anfang stand die Herausforderung …
So beginnt eine Geschichte, die jeder Forschende nachvollziehen kann: Eine Doktorandin in Polen steht vor einer praktischen wissenschaftlichen Herausforderung … Die Schwierigkeit bestand darin, einzelne Betablocker in einem komplexen Gemisch auf einfache und effiziente Weise zu identifizieren – das heißt, ohne jede Substanz einzeln injizieren zu müssen.
Sie bewegte sich damit im Bereich der Hochleistungsflüssigkeitschromatographie (HPLC), einer der leistungsfähigsten Analysetechniken zur Trennung vieler komplexer Verbindungsgemische. Doch selbst unter optimierten chromatographischen Bedingungen stehen Analytiker häufig vor der Herausforderung der Koelution, bei der zwei oder mehr Verbindungen gleichzeitig eluieren, was ihre individuelle Detektion und Quantifizierung erschwert. Dies gilt insbesondere für strukturell ähnliche Verbindungen wie Betablocker, die ein vergleichbares Retentionsverhalten aufweisen.


So schildert sie ihre Schwierigkeiten mit der Koelution von Betablockern: In einer kürzlich durchgeführten Studie untersuchten wir die Auftrennung von acht Betablockern unter Verwendung neuartiger Phosphodiester-Stationärphasen. Es handelte sich dabei um sogenannte polar eingebettete stationäre Phasen, die dank ihrer polaren und unpolaren Gruppen gemischte Eigenschaften aufweisen. Das Vorhandensein einer Phosphodiestergruppe und eines hydrophoben Liganden (C18-Kette, C10-Kette, Cholesterin-Gruppe oder Benzyl-Gruppe) in der Struktur der stationären Phasen ermöglichte die Retention von Verbindungen sowohl in Systemen der Umkehrphasen-Flüssigkeitschromatographie (RP LC) als auch der hydrophilen Interaktions-Flüssigkeitschromatographie (HILIC).
Die in dieser Studie verwendete Phosphatgruppe hatte einen pKa-Wert von 1,45, weshalb eine mobile Phase mit einem pH-Wert von 7,5 vorbereitet wurde. Unter diesen Bedingungen wurden sowohl die Phosphatgruppe als auch die analysierten Betablocker ionisiert, sodass während der Analysen – zusätzlich zu den hydrophoben Wechselwirkungen bei der RP LC und den hydrophilen Wechselwirkungen bei der HILIC – eine Elution nach einem kationischen Retentionsmechanismus stattfand.
Aufgrund ihrer unterschiedlichen Polaritäten und funktionellen Gruppen erwiesen sich Betablocker als besonders interessante Verbindungen für diese Studie, da sie sich ideal zur Charakterisierung der Selektivität von vier neuartigen Materialien (Diol-P-C10, Diol-P-Benzyl, Diol-P-Chol und Diol-P-C18) eignen. Zunächst versuchten wir, die Betablocker mittels isokratischer und Gradientenelution zu trennen. Dieser Ansatz reichte jedoch aufgrund der Peak-Koelution nicht aus, um eine vollständige Auflösung aller Verbindungen im Gemisch zu erreichen.
Im Fall der Doktorandin wurde die Problematik bereits bei den ersten Versuchen mit neuartigen Phosphodiester-Stationärphasen deutlich. Anstelle von eindeutigen, spitzen Peaks zeigten die Chromatogramme Ausläufer und breite Peaks, während mehrere Verbindungen zu einem einzigen Signal koeluierten. Die Anpassung der Gradienten und die Modifizierung der mobilen Phase führten zu einer Verbesserung, aber das reichte nicht aus. Einige Analyten blieben weiterhin unter überlappenden Peaks verborgen. Wie lässt sich das lösen?
Betrachtung der Problematik aus einem anderen Blickwinkel
An dieser Stelle tat die Doktorandin das, was jeder tun würde: Sie sprach mit ihrem Betreuer, der ihr einen anderen Ansatz vorschlug. „Sie müssen keine vollkommene Separation anstreben, wenn dies nicht erforderlich ist“, empfahl Dr. Szymon Bocian (Nikolaus-Kopernikus-Universität, Toruń, Polen). „Betrachten Sie die Daten aus einer anderen Perspektive. Versuchen Sie es mit i-PDeA II.“
Bei i-PDeA II (Intelligent Peak Deconvolution Analysis II) handelt es sich um eine fortschrittliche Datenverarbeitungstechnik, die in der LabSolutions Software verfügbar ist. Dr. Bocian war mit i-PDeA II bereits durch eine frühere Zusammenarbeit mit Shimadzu vertraut. Er kannte auch die Kapazitäten von PDA-Detektoren, die das gesamte UV-Spektrum über das Chromatogramm erfassen. Daher schlug er eine neue Strategie vor: Anstatt die chromatographischen Bedingungen immer weiter zu optimieren, könnte man doch mittels Spektraldekonvolution aufdecken, was das Chromatogramm nicht zeigt.
Einsatz digitaler Peak-Trennung
Obwohl die Phosphodiester-Stationärphasen und der kontrollierte pH-Wert der mobilen Phase eine verbesserte chromatographische Trennung ermöglichten, kam es bei einigen Betablockern weiterhin zu einer signifikanten Koelution. Anstatt umfangreiche Methodenentwicklungen zur Erzielung einer Basislinientrennung durchzuführen, begann das Team in Toruń nun, mit dem digitalen Tool i-PDeA II überlappende Peaks direkt aus den erfassten chromatographischen Daten aufzulösen. In Kombination mit Photodiodenarray-Detektoren (PDA) ermöglichte dieses Tool die Verwendung von 3D-PDA-Daten zur mathematischen Unterscheidung überlappender Peaks, selbst wenn diese auf dem Chromatogramm nicht visuell voneinander getrennt waren. (In diesem Verfahren wird mathematisch die Ableitung eines Spektrums, also einer Funktion, verwendet. Da die erste Ableitung an Hoch- oder Tiefpunkten den Wert Null annimmt, lassen sich mit dieser Methode überlagerte Spektren voneinander trennen. Die einzelnen Peaks können identifiziert und die entsprechenden Chromatogramme der jeweiligen Komponenten erstellt werden.)
i-PDeA II stützte sich dabei nicht nur auf die Retentionszeit, sondern analysierte das gesamte UV-Vis-Spektralprofil des Chromatogramms und extrahierte die Spektren der reinen Verbindungen, aus denen sich das Gemisch zusammensetzte. Dieser Ansatz ermöglichte nicht nur eine bessere Identifizierung, sondern minimierte auch den Aufwand für die Methodenentwicklung und die Analysezeit. Für die Forschungsarbeit der Doktorandin bedeutete dies einen entscheidenden Wendepunkt.


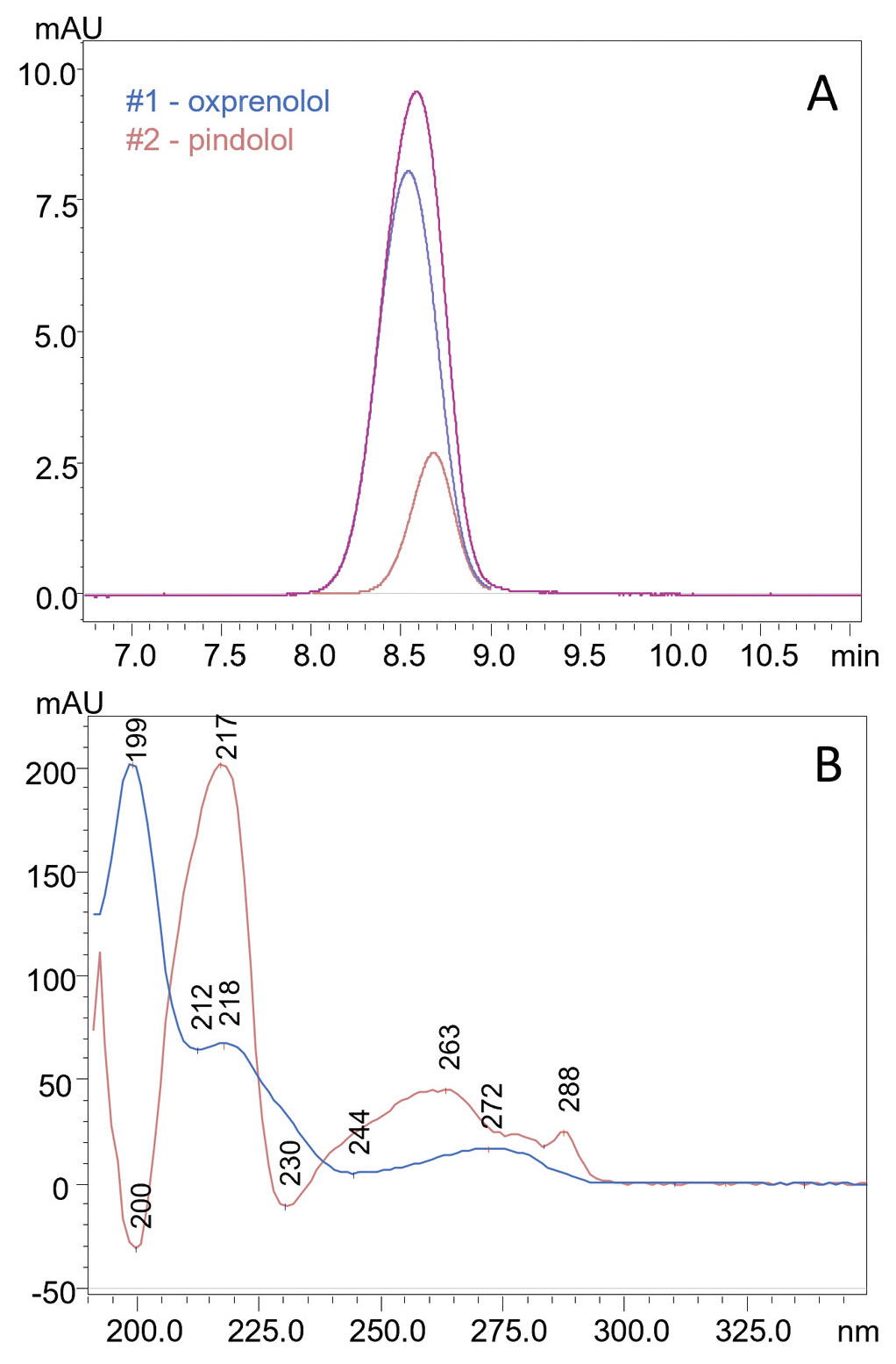
Erfolg Nr. 1: Auflösung von Oxprenolol und Pindolol
Eine der größten Herausforderungen für das Team bestand in der Koelution von Oxprenolol und Pindolol auf einer stationären Diol-P-C10-Phase unter HILIC-Bedingungen. Diese Verbindungen wiesen einen Selektivitätsfaktor von nur 1,01 auf, weshalb ihre Peaks kaum zu unterscheiden waren. Ohne Dekonvolution zeichnete der Detektor einen einzigen Peak auf, wodurch eine individuelle Analyse unmöglich war. Mit i-PDeA II gelang es jedoch, die beiden Komponenten durch Extraktion ihrer individuellen Spektren digital zu trennen (siehe Abbildung 1 und Tabelle 1).
| Spalte | Diol-P-C10 (125 mm 4,6 mm, 5 µm) |
| Bewegliche Phase | 10 mM CH3COONH4 in H2O pH 7,5:ACN (10:90 v/v) |
| Flussrate | 1 mL/min |
| Temperatur | 25°C |
| Injektionsvolumen | 10 µL |
| Analytische Wellenlänge | 254 nm |
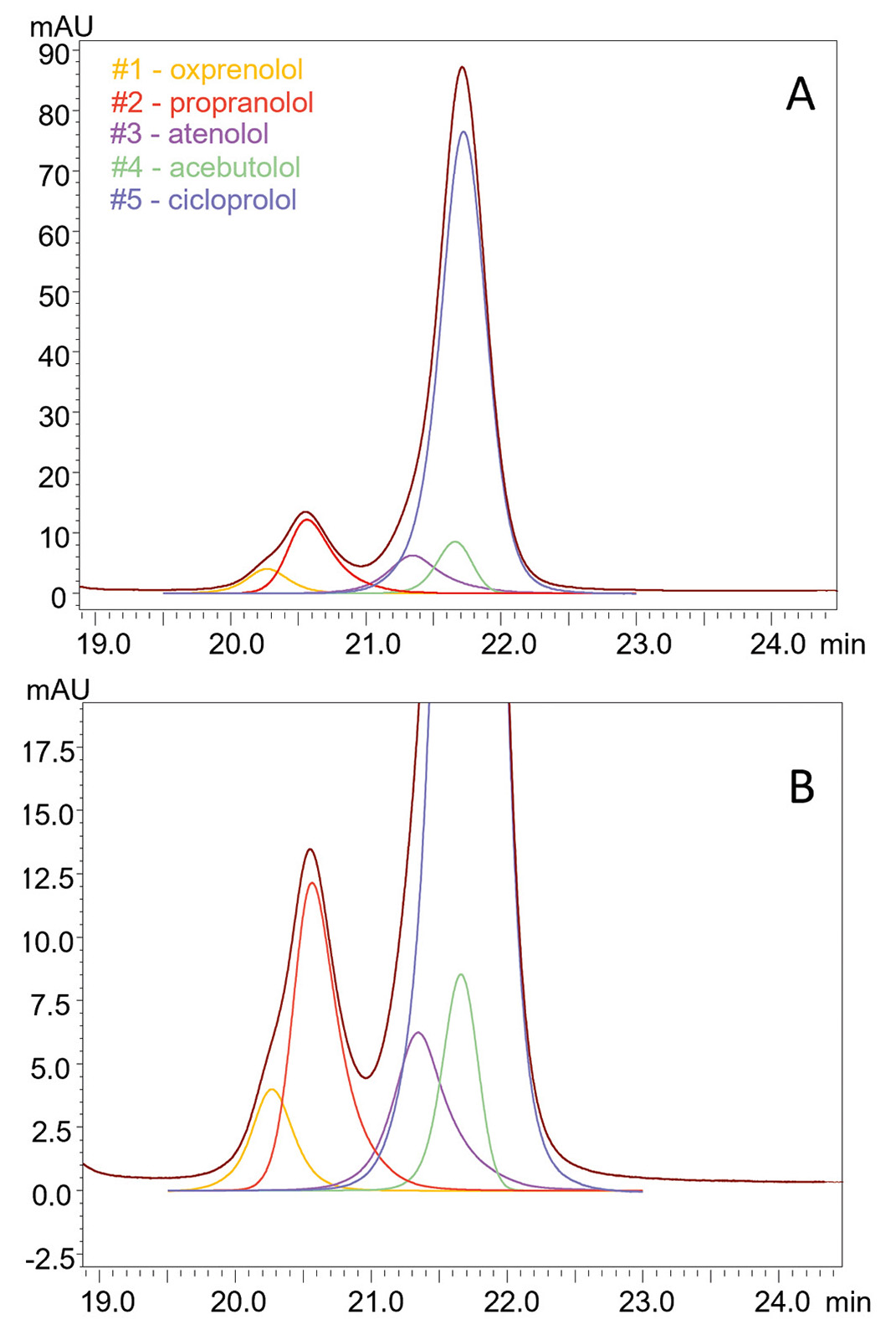
Erfolg Nr. 2: Gleichzeitige Dekonvolution von fünf Betablockern
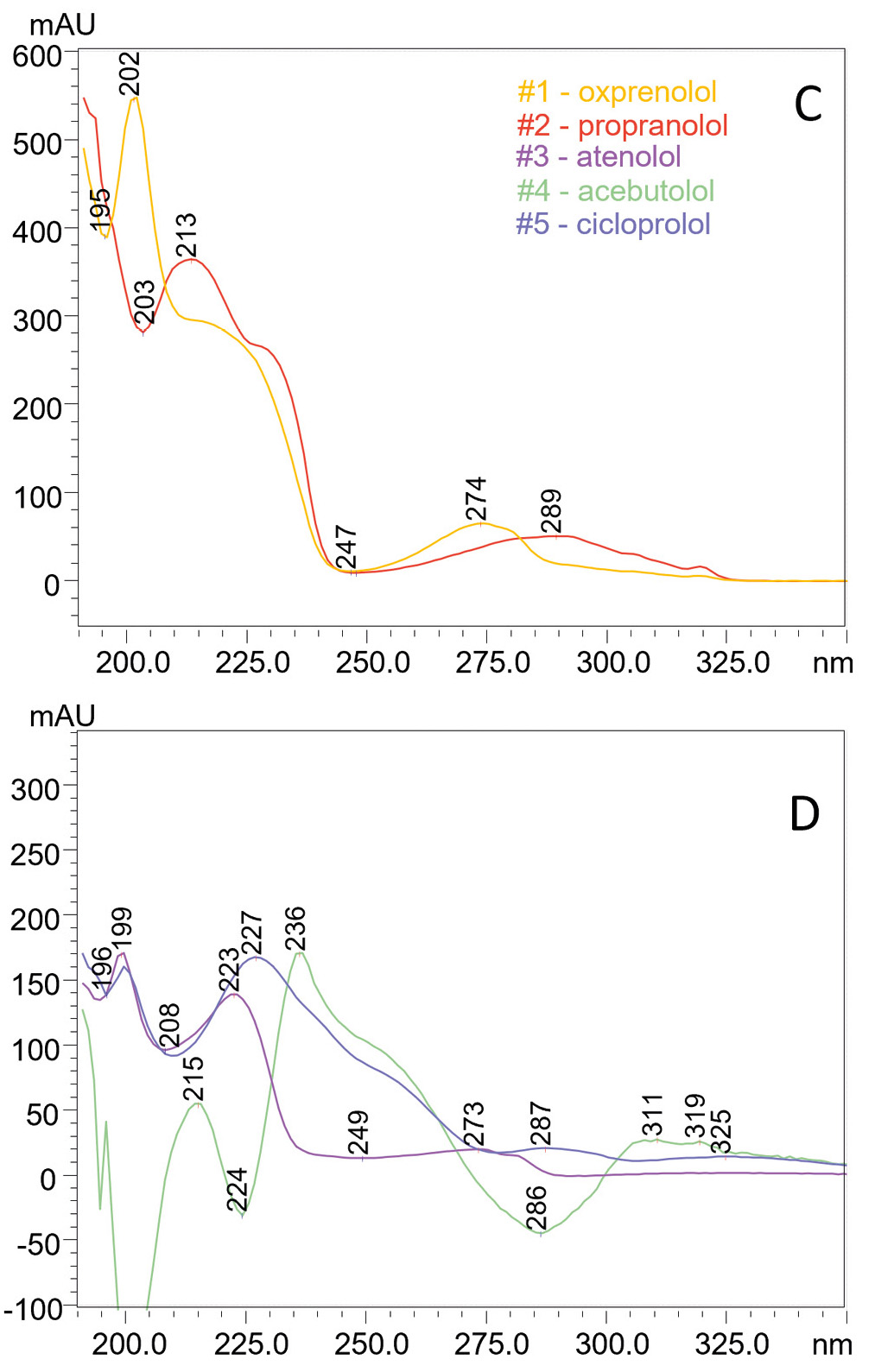
Der Einsatz von i-PDeA II zeigte auch, dass sich diese Funktion nicht nur zur Auflösung von zwei Peaks (z. B. zur Unterscheidung einer Verunreinigung vom Hauptanalyten) eignet, sondern auch zur Dekonvolution mehrerer koeluierter Verbindungen aus komplexen Gemischen. Bei einer Gradiententrennung auf der stationären Diol-P-Benzyl-Phase wurden die fünf Betablocker Oxprenolol, Propranolol, Atenolol, Acebutolol und Cicloprolol koeluiert. Die i-PDeA II Software analysierte die UV-Spektralunterschiede jeder Verbindung, wodurch diese identifiziert werden konnten (siehe Abbildung 2, Abbildung 3 und Tabelle 2).
Wo herkömmliche Trennmethoden an ihre Grenzen stoßen, überzeugt i-PDeA II
Die Herausforderung für die Doktorandin bestand darin, dass sich Betablocker mit konventionellen HPLC-Methoden nicht ausreichend trennen ließen und die Koelution strukturell ähnlicher Verbindungen ein Problem darstellte. Daher begab sie sich auf die Suche nach einer innovativen Lösung, die sie mit der Unterstützung ihres Betreuers in der Integration von i-PDeA II mit Phosphodiester-Stationärphasen fand und die in ihrer Studie erstmals auf diese Weise zum Einsatz kam.
Diese Integration erwies sich als unentbehrliches Hilfsmittel für diese Studie zur Trennung von Betablockern. Die digitale Trenntechnik ermöglichte es den Forschende, koeluierte Peaks anhand ihrer einzigartigen UV-Spektren aufzulösen, wodurch die Zuverlässigkeit der Analyse erheblich verbessert wurde. Die Ergebnisse zeigten, dass die Dekonvolution eine umfangreiche Methodenentwicklung ersetzen und die Analysezeit erheblich verkürzen kann, während gleichzeitig eine hohe Spezifität gewährleistet bleibt.
| Spalte | Diol-P-benzyl (125 mm 4,6 mm, 5 µm) |
| Bewegliche Phase (A: 10 mM CH3COONH4 in H2O pH 7,5; B: ACN) |
Gradient elution: 0 min – 11,8 min: 86% B 11,8 min – 11,9 min: 59% B |
| Flussrate | 1 mL/min |
| Temperatur | 25°C |
| Injektionsvolumen | 10 µL |
| Analytische Wellenlänge | 254 nm |



Ein deutlicher Fortschritt in der chromatographischen Analyse
Betablocker gehören zu den pharmakologisch wirksamen Substanzen und werden unter anderem in der Kardiologie eingesetzt. Außerdem werden sie Tieren beim Transport verabreicht, um deren Morbidität zu senken, wodurch sie auch in Fleisch und anderen tierischen Produkten nachweisbar sind. Die hier entwickelte Methode bietet eine nützliche neue Möglichkeit zur Analyse vieler Referenz- und Echtproben (Blut, Urin oder Abwasser), die in Studien zum Arzneimittelstoffwechsel, bei Anti-Doping-Tests und in der Spurenanalyse verwendet werden.
Diese Ergebnisse verdeutlichen auch die breitere Anwendbarkeit von i-PDeA II und zeigen deren Potenzial als leistungsstarkes Analysewerkzeug zur Auflösung von koeluierenden Verbindungen in komplexen Gemischen. Diese Methodik kann auch bei der Qualitätskontrolle von Arzneimitteln besonders nützlich sein, um Verunreinigungen, die sich möglicherweise unter dem Peak des Wirkstoffs verbergen, schneller und genauer nachzuweisen.
Oder, wie es die Doktorandin formuliert: „Mit i-PDeA II lassen sich verborgene Details aufspüren, die mit bloßem Auge in der herkömmlichen LC nicht sichtbar sind. Es ist, als würde man eine Spektralbrille aufsetzen, mit der man einzelne Farben in einem Lichtstrahl sehen kann, der sonst weiß erscheint.“
1. Kalisz O., Dembek M., Studzińska S., Bocian S. (2023). Beta-Blocker Separation on Phosphodiester Stationary Phases – The Application of Intelligent Peak Deconvolution Analysis. Molecules. 28: 3249. doi: 10.3390/molecules28073249.
2. Vecchietti D., Nishio A., Fujita Y., Yoshida T., Yanagisawa T., Kou D. (2022). Liquid chromatography coupled with photodiode array and a multivariate curve resolution – Alternating least square algorithm for identification and quantification of co-eluting impurities in pharmaceutical analysis. J Chromatogr A. 1678: 463364. doi: 10.1016/j.chroma.2022.463364.